


膜ATPase
細胞は、細胞膜の内外を、物質の濃度勾配に逆らって、物質を能動輸送している。
膜ATPaseは、イオンを、細胞膜の内外に、能動輸送させる輸送たんぱく質。
膜ATPaseは、ATP分解のエネルギーを利用して、膜内外の電気化学ポテンシャル差(電気化学的勾配)に逆らって、ポンプのように、物質を能動輸送をする(ATP駆動ポンプ)。
生体膜には、4群のATPase familyがある。
膜ATPaseは、輸送するイオンによって、Na+/K+-ATPase、H+-ATPase、Ca2+-ATPaseなどと呼ばれる。
H+-ATPaseには、ミトコンドリアのF型H+-ATPase(複合体V)、形質膜のP型H+-ATPase、液胞のV型H+-ATPaseの3種類がある。
1.F型ATPase群
ミトコンドリア内膜に存在する、F型H+-ATPaseが、ATP合成酵素(複合体V)。F0F1から構成されているため、F型と呼ばれる。
F型ATPaseに異常があると、ATP合成を解糖で補おうとするため、高乳酸血症になる。
F型ATPaseの異常を来たすミトコンドリア筋脳症には、KSS(Kearns-Sayre症候群)、MELAS(mitochondrial myopathy, encephalopathy, lactic acidosis and stroke like-episodes)、MERRF(myoclonus
epilepsy with ragged red fibers)がある。
2.V型ATPase群
細胞内の液胞(vesicle)などの細胞内膜に存在するため、V型と呼ばれる。
液胞内のpHの制御、物質貯蔵に重要。
V型H+-ATPaseは、リソソーム、エンドソーム、ゴルジ体、シナプス小胞、クロマフィン顆粒などの細胞内膜に存在し、細胞液側から、内膜の内側にH+を輸送する。
V型H+-ATPaseは、シナプス小胞に神経伝達物質を貯蔵する。
リソソームの膜に存在するH+-ATPase(プロトンポンプ)は、リソソーム内をpH5程度の酸性に保ち、加水分解酵素活性を維持する。
3.P型ATPase群
形質膜(plasma membrane)に存在するため、P型と呼ばれる。
細胞内液と細胞外液との間をカチオンを輸送する:神経細胞や筋細胞の興奮に伴い、チャネルを移動して細胞内に流入するNa+、細胞外に流出するK+を、元の濃度に維持する。
胃液の分泌、銅代謝にも重要。
P型ATPaseは、E型ATPaseとも呼ばれる。
P型ATPaseには、形質膜に存在する、Na+/K+-ATPase、H+/K+-ATPase、Ca2+-ATPase、P型H+-ATPase、Cu2+-ATPaseがある。
a.Na+/K+-ATPase
Na+/K+-ATPase(Na+,K+-ATPase:Sodium Pump)は、3ケのNa+を細胞外に汲み出すのに伴い、2ケのK+を細胞内に取り込む。
Na+/K+-ATPaseは、すべての細胞に存在する。
Na+/K+-ATPaseは、細胞内のNa+を細胞外に、能動的に汲み出す、Na pump(Naポンプ)。
細胞膜は、Na+は不透過だが、水は透過させるので、 Na+を細胞外に汲み出せないと、浸透圧の関係で、水が細胞質に流入して、細胞が破壊される恐れがある。
Na+/K+-ATPaseにより、イオン濃度の勾配が形成され、新たに、細胞の反対側から、Na+が輸送される。
予め細胞質内に存在するNa+/K+-ATPaseは、アルドステロン、cAMP、vasopressinにより、細胞膜表面にリクルートされる。
腎皮質の集合管では、細胞内Na+濃度([Na+]i)が上昇すると、Na+/K+-ATPase活性が増加する(注1)。
Na+/K+-ATPaseは、K+チャネルと、共役的に働く:Na+/K+-ATPaseにより、細胞内で増加するK+イオンは、K+チャネルが働いて、K+チャネルを介して、細胞外に放出される。
Na+/K+-ATPaseは、Na+/H+交換輸送体と共役的に働く:Na+/K+-ATPaseにより、細胞内で減少するNa+イオンは、Na+/H+交換輸送体を介して、細胞外から細胞内に、受動輸送される。
腎臓は、エネルギー代謝が盛んな臓器だが、腎臓で生成されるATPの90%以上は、Na+/K+-ATPase(Naポンプ)が消費する。
脳は、基礎代謝量の約20%のエネルギーを消費する。脳で消費される基礎代謝のエネルギーの50%以上は、Na+/K+-ATPase(Naポンプ)が消費する。
体内の基礎代謝のエネルギーの40%以上は、能動輸送の為、ATPaseが消費する。
表1 臓器別基礎代謝量(参考文献の田川邦夫氏の表2-1を改変し引用)
| 臓器 |
酸素(O2) |
ATP |
比率(%) |
| mmol/分 |
mol/日 |
mmol/分 |
mol/日 |
| 肝臓(腹部を含む) |
2.63 |
3.8 |
15.78 |
22.7 |
26 |
| 脳 |
1.85 |
2.7 |
11.10 |
16.0 |
19 |
| 心臓 |
0.67 |
1.0 |
4.02 |
5.8 |
7 |
| 腎臓 |
1.02 |
1.5 |
6.12 |
8.8 |
11 |
| 骨格筋 |
1.77 |
2.6 |
10.62 |
15.3 |
18 |
| 残部 |
1.89 |
2.7 |
11.34 |
16.3 |
19 |
| 合計 |
9.83 |
14.2(453g) |
58.95 |
84.9(43g) |
100 |
基礎代謝の基礎エネルギー消費量(basal energy expenditure:BEE)は、下記のハリス・ベネディクトの式(Harris-Benedict)により求められる。
・男性:66.47+(13.75×体重)+(5.0×身長)-(6.76×年齢)
・女性:655.10+(9.56×体重)+(1.85×身長)-(4.68×年齢)
Na+/K+-ATPaseによって、細胞内と細胞外に、Na+の濃度勾配が形成され、この濃度勾配を利用して、糖やアミノ酸などが、協奏的にチャネルから、細胞内に取り込まれる。
小腸や、腎臓の尿細管では、Na+は、グルコース(ブドウ糖)と共に、Na+-ブドウ糖共輸送体(SGLT:sodium-dependent glucose transporter))により、細胞内に取り込まれた後、Na+/K+-ATPaseにより、細胞外(血管側)に汲み出される(グルコースは、小腸では、GLUT2により、血管側に輸送される)。
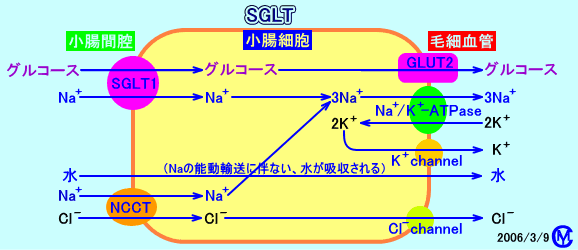
遠位尿細管上皮細胞では、基底膜側(血管側:basolateral site)からNa+/K+-ATPaseで、Na+を血中に汲み出し、刷子縁膜側(尿細管腔側:apical site)のNa+チャネル(ENaC:epithelial sodium channel) から、尿細管腔の原尿中のNa+を、細胞内に流入させる。この際、同時に、K+は、血液中から尿細管腔へ転送される。
アルドステロンにより、Na+再吸収が促進される:アルドステロンは、細胞質内に予め存在するNa+/K+-ATPaseを、基底膜側の細胞膜表面にリクルートさせる。その結果、アルドステロンは、尿細管細胞の刷子縁膜側(尿細管腔側:apical site)では、Na+チャネル(lENaC)を活性化させ、尿細管腔内(原尿中)のNa+を細胞内に流入させ、基底膜側(血管側:basolateral site)では、Na+/K+-ATPase(Na pump)を活性化させ、Na+を細胞内から細胞外(血管中)に汲み出すことで、Na+の再吸収を促進させる。
インスリンには、Na+/K+-ATPaseを、細胞質から、細胞膜にトランスロケーションさせる作用があるという。
プロスタグランジンE2(PGE2)、プロスタグランジンI2(PGI2)、プロスタグランジンF2(PGF2)、5-HEPETEは、結果的に(注2)、Na+/K+-ATPaseの活性を低下させる(PGD2、PGE1は、影響しない)。
糖尿病で高血糖になると、ソルビト-ルが細胞内に増加して、Na+/K+-ATPase活性と低下させ、電気的刺激伝導を遅延さ、糖尿病性神経障害が起こる。
強心剤のジギタリス剤は、Na+/K+-ATPaseによるNa+の汲み出しを阻害し、細胞内Na+濃度が上昇する。そして、Na+/Ca+交換輸送体が働き、Na+を細胞外へ汲み出し、交換に 細胞内へCa2+が輸送され、細胞内遊離Ca2+濃度が上昇し、心筋収縮力が増加する。
脳血管障害などで、脳細胞が虚血状態に陥ると、ATPが枯渇し、Na+/K+-ATPaseなどが、機能しなくなり、細胞は、脱分極を起こす。その結果、電位依存性Ca2+チャネル(VDCC)から、Ca2+が細胞内に流入して、グルタミン酸が興奮性神経伝達物質として放出される。また、細胞内Ca2+濃度の上昇により、細胞内のCa2+依存性プロテアーゼが活性化され、細胞死(Ca2+ mediated cell death)が起きる。
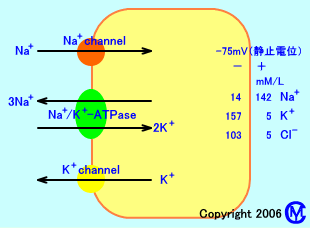
細胞膜のNa+/K+-ATPaseにより、細胞内は、K+が多く、細胞外は、Na+が多く、-75mV程度の静止電位になっている。細胞内電位が高まると、Na+チャネルが開き、細胞外のNa+が、細胞内に流入し、細胞内電位が、上昇する。しかし、細胞内電位が、+35mv程度(活動電位)になると、Na+チャネルは閉じて、反対に、K+チャネルが開いて、細胞内のK+が、細胞外に流出し、細胞内電位が、-80mV程度に低下する。そして、再び、Na+/K+-ATPaseにより、Na+を細胞外に汲み出し、K+を細胞内に取り込むので、-75mV程度の静止電位に維持される。
Na+/K+-ATPaseは、腎尿細管の血管側に存在し、細胞内のNa+を血管側に汲み出し、細胞内のNa+濃度を低下させ、細胞内を陰性(負)に荷電させる。この電気化学的勾配に従って、原尿中のNa+は、尿細管腔側から細胞内に流入する。
アミノ配糖体抗生剤(ゲンタマイシン、アミカシン、トウラシン等)は、大量長期投与すると、腎尿細管の機能障害や、形態的障害を来たす。特に、近位尿細管は、アミノ配糖体抗生剤が蓄積し尿細管壊死に陥る(アミノ配糖体抗生剤は、尿細管腔側から細胞嚥下作用により吸収され、近位尿細管細胞質内のライソゾームに蓄積する)。
アミノ配糖体抗生剤(ゲンタマイシン)は、近位尿細管(PT)細胞に取り込まれた後、30分以内に、Na+/K+-ATPase活性を、抑制する。アミノ配糖体抗生剤(ゲンタマイシン)は、ヘンレ上行脚太い部(TAL)細胞のNa+/K+-ATPase活性は、抑制しない。
b.H+/K+-ATPase
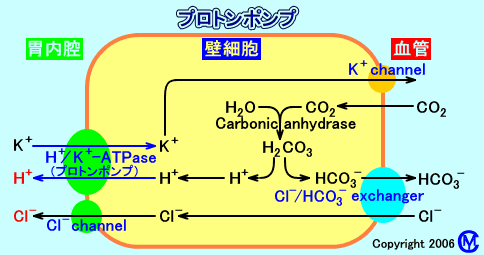
H+/K+-ATPaseは、胃の壁細胞から塩酸(HCl)を分泌する際に必要な、胃のプロトンポンプ(H+ポンプ)。
H+/K+-ATPaseは、胃の内腔に水素イオン(H+)を分泌し(胃の内腔は、pHが1程度になる)、壁細胞内にK+を輸送する。水素イオン(H+:酸)は、約400万倍の濃度勾配に逆らって、壁細胞から、胃の内腔に、分泌される。
壁細胞内では、水(H2O)が、H+とOH-に分解される。H+は、胃内腔側のH+/K+-ATPaseにより、胃の内腔に分泌される。OH-はCO2と結合して、重炭酸イオンHCO3-となり、血管側のCl-/HCO3-交換輸送体により、壁細胞外(血液中)に放出され、交換に、血液中のCl-が、壁細胞内に取り込まれる。
壁細胞表面に存在するH+/K+-ATPaseは、胃の内腔にH+を分泌し、交換に、壁細胞内に、K+を取り込む。
H+/K+-ATPaseで細胞内に輸送されたK+は、K+チャネル(K+ channel)によって、細胞外(胃内腔側)に受動輸送される。その際、壁細胞内のプラスイオンとマイナスイオンの平衡を保つ為に、Cl-が細胞外(胃内腔側)に輸送される。
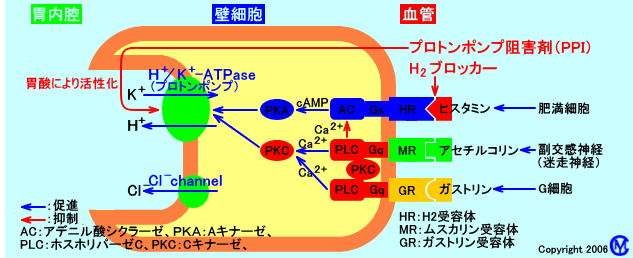
なお、壁細胞のH+/K+-ATPaseは、ヒスタミンH2受容体(肥満細胞からの刺激を受け取る)、ガストリン受容体(血行性の刺激を受け取る)、ムスカリン受容体(神経からアセチルコリンの刺激を受け取る)からの刺激で活性化される:ヒスタミンH2受容体は、ヒスタミンと結合すると、cAMP濃度を上昇させ、プロテインキナーゼを活性化させ、H+/K+-ATPaseを活性化させる。ガストリン受容体はガストリンと結合すると、また、ムスカリン受容体は、アセチルコリンと結合すると、Ca2+(カルシウムイオン)濃度を上昇させ、プロテインキナーゼを活性化させ、H+/K+-ATPaseを活性化させる。
ヒスタミンH2受容体拮抗剤(H2ブロッカー)は、H+/K+-ATPaseを抑制し、胃酸分泌を抑制し、胃潰瘍、十二指腸潰瘍に、治療効果を現わす。他方、内因性のプロスタグランジン(PGE2)が、被蓋上皮細胞や壁細胞から産生され、胃酸分泌を抑制すると同時に、細胞増殖や血管新生を促進し、サイトプロテクション(細胞保護)する作用を現わす。ヒスタミンH2受容体拮抗剤は、内因性のプロスタグランジン(PGE2)を減少させ、良質な潰瘍治癒を阻害する恐れがある。
プロトンポンプ阻害剤(医薬品名:パリエット錠10mgなど)は、H+/K+-ATPase(プロトンポンプ)のSH基を修飾して、酵素活性を阻害し、胃酸分泌を抑制し、胃潰瘍、十二指腸潰瘍に、効果を現わす。
プロトンポンプ阻害剤(PPI)は、壁細胞に達した後、分泌細管に移行し、酸により活性体になり、H+/K+-ATPase(プロトンポンプ)に結合して不活化させ(活性を抑制する)、ヒスタミン、ガストリン、アセチルコリンによる胃酸分泌を抑制する。
プロトンポンプ阻害剤(PPI)は、H+/K+-ATPase(プロトンポンプ)に徐々に結合して行くか、H+/K+-ATPase(プロトンポンプ)の活性が不活化されるのに時間を要する。その為、プロトンポンプ阻害剤(PPI)は、投与開始してから、胃酸分泌が抑制される(胃酸分泌抑制効果が現れる)まで、ヒスタミンH2受容体拮抗剤(H2ブロッカー)より時間を要する。
「潰瘍は夜つくられる」と言うフレーズがあるが、十二指腸潰瘍の再発は、迷走神経を介する、夜間の胃酸分泌亢進によることがある。しかし、ヒスタミンH2受容体拮抗剤(H2ブロッカー)は、朝投与する(8:00amに内服する)方が、就寝前投与する(10:00pmに内服する)より、十二指腸潰瘍の治癒率が、高い。従って、胃潰瘍や十二指腸潰瘍の治療に於いて、夜間の胃酸分泌亢進を抑制することは、重要だが、昼間の胃酸分泌亢進を抑制することの方が、重要とされる。
夜間酸分泌現象(NAB:nocturnal gastric acid breakthrough)とは、「夜間に胃内pHが4以下を示す割合が1時間以上継続する現象」のこと(Peghini等)。
胃内にピロリ菌(H. pylori)が陽性の人は、NABが認められないが、ピロリ菌が陰性の人は、胃酸分泌を抑制するプロトンポンプ阻害剤(PPI)を内服しても、NABが起こる。ピロリ菌が陰性の人は、夜間には、NABを含めて、胃内pHが低くなる傾向がある。
ピロリ菌が陰性の人に、ヒスタミンH2受容体拮抗剤(H2ブロッカー)を投与すると、次第に、胃酸分泌抑制効果が弱まって行く(寛容):ピロリ菌が陰性の人に、H2ブロッカーを注射で投与すると2~3日以内に、また、経口投与すると2週間以内に、胃酸分泌抑制効果が減弱してしまう。ピロリ菌が陽性の人では、H2ブロッカーを投与し続けても、胃酸分泌抑制効果の減弱は起こらない。
プロトンポンプ阻害剤(PPI)を服用した群の方が、PPIを服用しなかたりH2ブロッカーを服用した群より、バレット食道患者における異形成(dysplasia)の発生率が、有意に低い。
プロトンポンプ阻害剤(PPI)は、朝食前(朝食30分程前)に服用することが奨励される。
プロトンポンプ阻害剤(PPI)のラベプラゾールナトリウム(商品名:パリエット錠)は、経口投与後に、腸管から吸収され、血中に移行し、胃の壁細胞の分泌細管から分泌され、分泌細管の管腔内で、胃酸と反応し、活性体(スルフェンアミド体)に変化(プロトネーション)する。ラベプラゾールナトリウム(商品名:パリエット錠)は、「難治性逆流性食道炎における維持療法」と言う病名で、1日1回10mgの経口投与が、8週間以上、保険適応がある(再発・再燃を繰り返す逆流性食道炎の維持療法においては1日1回10mgを経口投与する)。
活性体のPPIは、分泌細管の管腔内(管腔側)で、分泌細管膜に存在する胃プロトンポンプのSH残基(細胞外部側表面に存在する)に結合し、プロトンポンプ(H+/K+-ATPase)の活性を阻害し、胃酸分泌を抑制する。
PPIのラベプラゾールナトリウムは、(分泌細管の管腔内胃液の)pHが1の場合には、約1分で、半量が活性体に変化する。
壁細胞(プロトンポンプが存在する胃酸分泌細胞)は、胃腺上部の増殖帯で誕生し、胃腺内を下部方向(胃内腔と反対方向)に、移動する。胃腺の表面上皮細胞の寿命は約1週間だが、壁細胞(胃酸分泌細胞)の寿命は約5カ月間と長い。若い胃壁細胞(酸分泌能が高い)は、胃腺の胃内腔に存在し、老化した胃壁細胞(産分泌能が低い)は、胃腺の下部に存在する。その為、胃腺(分泌細管)内の酸度(pH)は、1でなく、4~5程度に低い。
PPIが活性体に変化(プロトネーション)するのに必要なpH(pKa)は、普通のPPIは4以下だが、ラベプラゾールナトリウムは5であり、薬効発現が早い(投与1日目から現れる)と言う。
プロトンポンプ阻害剤(PPI)は、心筋梗塞後の抗血小板療法としてクロピドグレル(プラビックス錠)を服用している患者に併用投与すると、心筋梗塞を再発するリスクが40%増加すると言う。
ヒスタミンH2受容体は、アデニル酸シクラーゼ系(AC系)により、細胞内cAMP濃度を上昇させ、Aキナーゼ(PKA)を活性化させ、H+/K+-ATPase(プロトンポンプ)を活性化させる。
ガストリンとアセチル コリンは、ホスホリパーゼC系(PLC系)により、IP3を生成し、細胞内Ca2+濃度を上昇させ、Cキナーゼ(PKC)を活性化させ、H+/K+-ATPase(プロトンポンプ)を活性化させる。
PGE2は、cAMPの産生を抑制する(EP3受容体を介してACを抑制する)ので、ヒスタミンによるH+/K+-ATPase(プロトンポンプ)の活性化を抑制し、胃酸分泌を抑制する。
ピロリ菌(Helicobacter pylori)は、宿主の胃に炎症を起こし、胃粘膜の壁細胞からの胃酸分泌を低下させる。
ピロリ菌は、抗生剤(抗生物質)を使用しない国では、7割以上の子供が、10歳までに感染し、保菌者となることが多い。ピロリ菌は、米国等の先進国では、保菌者が少ない。
ピロリ菌は、CagA蛋白を胃粘膜上皮細胞に注入し、好中球を浸潤させ、炎症を誘発したり、VacA蛋白を分泌し、胃粘膜上皮細胞内部に空洞を形成し、ヘルパーT細胞を抑制する。ピロリ菌の保菌者は、消化性潰瘍や、胃癌になるリスクが、高まる。ピロリ菌の保菌者でなくなると、胃食道逆流症(GERD)により、食道下部が、強酸性の胃内容物に暴露され、食道に炎症が起こり、食道腺癌になるリスクが高まる。
CagA遺伝子を有するピロリ菌は、胃内酸度が高まると、CagA蛋白を産生し、胃粘膜に炎症を誘発し、胃壁細胞からの胃酸分泌を抑制する。
ピロリ菌は、人類の移動と共に、世界に広がった:アマゾンの先住民達の胃内のピロリ菌株は、東アジア(中国や日本等)の人々の胃内のピロリ菌と同様に、s1c遺伝子型であり、アマゾンの先住民達は、東アジアの人々(モンゴロイド)が、ベーリング海峡を横断して、アメリカに移動し、アマゾンに住み着いたものと考えられている。
胃潰瘍・十二指腸潰瘍におけるヘリコバクター・ピロリ感染症に対しては(除菌療法)、成人では、クラリスロマイシン400mg/日(クラリシッド錠200mg/1回)、アモキシシリン水和物1,500mg/日(サワシリンカプセル250mg3錠/1回)、オメプラゾール40mg/日(オメプラゾン20mg/1回)を、7日間、内服させる(平成21年3月30日付で保険適応が承認=厚生労働省医薬食品局長通知:薬食発第0330002号)。
プロトンポンプ阻害剤(PPI)は、プロトンポンプ(PP)に非可逆的に結合するので、一旦結合すると遊離しないので、新たに胃壁細胞にプロトンポンプが形成されるまで、胃酸分泌を抑制する。
ヒスタミンH2受容体拮抗剤(H2ブロッカー:H2RA)は、血中濃度が低下すると、急速に胃酸分泌抑制作用が消失する。
ガストリンは、胃壁細胞に作用して、胃酸分泌を刺激する以外に、好クロム細胞(ヒスタミンを分泌する)にも作用する。ガストリンは、胃腸粘膜の過形成を引き起こす。
プロトンポンプ阻害剤(PPI)は、ビタミンB12(胃からの吸収に胃酸の存在が必要)の吸収を抑制し、臨床的に意味を持つ程度にビタミンB12を欠乏させることはないと言われている。
PPIは、(胃腸からの)カルシウム吸収を阻害するので、高用量のPPIは、長期に使用すると、大腿骨骨折が増加する(破骨細胞内のプロトンポンプを阻害し骨からのカルシウム細吸収をは抑制する)。
プロトンポンプ阻害剤(PPI)の投与は、ヒスタミンH2受容体拮抗剤(H2RA)の投与と異なり、市中肺炎の罹患率を高める。
プロトンポンプ阻害剤(PPI)やヒスタミンH2受容体拮抗剤(H2RA)は、強力に胃酸分泌を抑制するが、胃の生理機能を低下させるおそれは、一般的に低いと考えられている。
ファモチジン(医薬品名:ガスターD錠10mg)を1日3回内服すると、便秘が解消した症例がある。
プロトンポンプ阻害剤(PPI)は、心筋梗塞後の抗血小板療法としてクロピドグレル(プラビックス錠)を服用している患者に併用投与すると、心筋梗塞を再発するリスクが40%増加すると言う。
c.Ca2+-ATPase
Ca2+-ATPaseは、細胞膜(細胞質膜)や、小胞体(筋小胞体や、粗面小胞体等)に存在する。
小胞体(小胞体)の内に蓄えられたCa2+(カルシウムイオン)は、細胞質内に放出された後、Ca2+-ATPaseにより、小胞内に戻される:作動薬で刺激すると、筋小胞体からは、20μMのCa2+が一気に放出されるが、遊離Ca2+濃度の増加は、1μM以下だと言う。
このため、Ca2+濃度は、細胞内(細胞質ゾル)が10-7Mと低いのに対し、小胞体内は1~2mMと、細胞外のCa2+濃度とほぼ同じ濃度に保たれる:細胞内(細胞質ゾル)Ca2+濃度(Cac)は10-7Mで、細胞外Ca2+濃度(Cao)の10-3M、小胞体内Ca2+濃度の10-3M(1mM)よりも、10,000倍も低い。
筋肉が収縮する際には、細胞膜のCa2+チャネルが刺激されると、筋小胞体から蓄えられていたCa2+が放出され、筋肉が収縮する(注3)。
小胞体Ca2+-ATPase(sarcoendoplasmic reticulum Ca2+-ATPase:SERCA)2b遺伝子が変異すると、ダリエー病と言う皮膚病を発症する。
Ca2+-ATPaseは、Caポンプとして機能する。
Caポンプ(Ca2+/Mg2+-ATPase)は、細胞質のCa2+濃度が、10-5M以上になると、作動する。
d.H+-ATPase
P型H+-ATPaseは、形質膜にあり、細胞質内から細胞外へH+を輸送するプロトンポンプ(注4)。
e.Cu2+-ATPase
Cu2+-ATPaseは、肝臓での銅の代謝に関与している。
銅輸送蛋白である、Cu2+-ATPaseの異常で起こるのが、Menkes病やWilson病(注5)。
4.ABC輸送体
ABC輸送体(ABC ATPase)は、2ケのATP結合部位を有し、ATP-binding cassette transporter(ATP-結合カセット輸送蛋白)と総称される。
生体に侵入した、毒物や薬物の排出(肝臓、腎臓、大腸)、塩素イオンの輸送、などの機能がある。
制癌剤耐性に関与するABC輸送体には、ポンプ機能が、カルシウム拮抗剤により阻害されるものもある。
嚢胞性線維症(cystic fibrosis)は、気道、腸管、汗腺などで、塩素イオンを輸送する、CFTR(cystic fibrosis taransmembrane conductance
regulator)と呼ばれる、ABC輸送体の、ATP結合部位の変異が原因で起こる。
ミトコンドリアでのATP合成速度に応じて、細胞活動を制御する、KATP(ATP依存Kチャネル)も、ABC輸送体。
注1: 細胞内Na+濃度([Na+]i)が上昇するような場合は、原尿中のNa+濃度が高い場合なので、刷子縁膜側のNa+チャネル(ENaC)を閉じて、細胞内へのNa+流入を減少させ、Na+再吸収を抑制するものと思われる。
注2:cAMPは、PKA(Aキナーゼ)を活性化させ、PKAは、Na+/K+-ATPase、Na+チャネル(ENaC)、K+チャネル、Cl-チャネル、Na+-K+-2Cl-共輸送体、K+-Cl-共輸送体を活性化させ、Na+/H+交換輸送体を抑制する。PGE2は、EP3受容体を介しては、アデニル酸シクラーゼ(AC)を抑制し、cAMPの産生を抑制し、PKAによるNa+/K+-ATPase(H+/K+-ATPase)の活性化を抑制する。
注3:筋肉が収縮するには、まず、運動神経に活動電位が伝導され、神経末端の神経終末のCa2+チャネルが開き、Ca2+が、神経細胞内に流入する。そうすると、シナプス小胞と細胞膜が融合して、アセチルコリンが、シナプス間に放出され、筋細胞の終板のニコチンMレセプターに、結合する。そうすると、ニコチンMレセプターのNa+チャネルが開き、Na+が、筋細胞内に流入し、発生する終板電位が閾値に達すると、電位依存性Na+チャネルが開口し、筋細胞に活動電位が発生する。筋細胞に発生した活動電位は、筋細胞の細胞膜に沿って、伝導され、T管内を経て、筋小胞体に達する。そうすると、活動電位が、T管のジヒドロピリジン受容体から、筋細胞のライアノジン受容体に伝導され、筋小胞体のCa2+遊離チャネルが開口し、Ca2+が、筋小胞体から、筋細胞内に、放出される(カフェインは、筋小胞体のCa2+遊離チャネルを、開口し易くし、Ca2+の放出を増加させる)。放出されたCa2+は、アクチン上のトロポニンCに結合し、アクチンが、ミオシンに滑り込み、筋細胞が収縮する。その後、トロポニンCから、Ca2+が遊離し、筋細胞は、弛緩する。遊離したCa2+は、筋小胞体のCa2+-ATPaseにより、再吸収される。
ハロタン麻酔などで、悪性高熱が起こるのは、筋小胞体のCa2+遊離チャネルを開口させ、発熱などが、起こると言う。
筋肉が収縮するには、まず、(運動神経に伝導される活動電位により、)筋原線維を取り囲む筋小胞体から、Ca2+が放出(遊離)される。
Ca2+は、ミオシン(ATP分解酵素として働く)を活性化し、ATPが 分解され、遊離されるエネルギーにより、アクチンフィラメントが、ミオシンフィラメントの間に滑り込み、筋肉は収縮する。
Ca2+が、Ca2+-ATPaseにより、筋小胞体に、に再吸収されると、ATPが分解されなくなり、アクチンフィラメントが、元の状態に戻り、筋肉は弛緩する。
注4:植物では、 細胞内のH+が、細胞外に汲み出されると、細胞壁にH+が蓄積し、細胞壁が伸び易くなり、植物は、成長する。
細胞内のH+を汲み出し、細胞質の酸性化を防ぐ作用は、P型H+-ATPaseより、Na+/H+交換輸送体(Na+/H+ exchanger:NHE)の方が、担っていると言う。
Na+/H+交換輸送体(Na+/H+交換ポンプ)は、受動輸送をするだけなので、駆動力供給装置として、Na+/K+-ATPase(Naポンプ)が共役的に働くことが必要:Na+/K+-ATPaseが、細胞内のNa+濃度を低くすることにより、Na+/H+交換輸送体による、細胞内へのNa+の流入を助け、細胞外へのH+排出を、促進させる。
注5:Menkes病は、ATP-7Aと呼ばれる、6個の銅を結合するP型ATPase(銅輸送蛋白)に欠陥があり、銅が腸管から粘膜細胞に取り込まれた後、粘膜細胞内から、門脈側に輸送されず、銅欠乏症状を示す(X連鎖性劣性遺伝)。そして、腸管粘膜細胞や、近位尿細管に、銅がメタロチオネイン-銅(MT-Cu)の形で蓄積するが、門脈側や尿細管血管側に銅が分泌されないので、健常者より、Menkes病では、肝臓や脳の銅濃度は、低値になる。
Wilison病では、ATP-7Bと呼ばれる、6個の銅を結合するP型ATPase(銅輸送蛋白)に異常があり、肝臓から、胆汁中へ銅を排泄出来ない。また、セルロプラスミンに銅を結合させ、血中に分泌出来ないため、Wilison病では、肝臓や脳の銅濃度は、高値になる(常染色体劣性遺伝)。
ヒトでは、胃・十二指腸と小腸上部から銅を吸収している。ATP-7Aは、粘膜細胞の腸管腔側に存在し、銅を吸収している。細胞に取りこまれた銅は、細胞質内をATP-7Bに結合して、搬送され、門脈側の細胞外に分泌され、門脈血中のアルブミンや含硫アミノ酸と結合して肝臓に輸送される。
肝臓は、健常者でも、ATP-7Aを発現していない。
参考文献
・香川靖雄:膜ATPase familyと疾患 小児科 Vol.38 No.12、1499-1505、1997年.
・竹本忠良:眼でみる消化性潰瘍-最近のトピックス- (株式会社 スタンダード・マッキンタイヤ、1993年).
・田川邦夫:からだの働きからみる代謝の栄養学 タカラバイオ株式会社(2003年).
・井上正規:酸分泌抑制効果発現をめぐって NIKKEI MEDICAL 1993年1月10日号、96-99.
・河原克雅、佐々木克典:カラー図解 人体の正常構造と機能 III消化管 日本医事新報社、2003年.
・福田豊、藪田敬次郎:ゲンタマイシン腎障害とNa+,K+-ATPase活性 小児科 Vol.32 No.4、403-405、1991年.
・田中隆莊、田中昭男:筋収縮とタンパク質 新編生物図解、140-141、2000年(第一学習社).
・M. J. ブレイザー:特集 清潔社会の落とし穴 ピロリ菌の意外な効用、日経サイエンス、2005年5月号、22-29頁.
・木下芳一、竹口紀晃:プロトンポンプ探求シリーズ、H.pylori感染の有無と胃酸分泌動態、エーザイ株式会社、CODE
PT(1)369(2005年8月作成).
・竹口紀晃:胃酸分泌細胞とPPIの関係、PPI活性体生成に必要なpHと作用の早さ、エーザイ株式会社、CODE
PT(1)304-4(2005年8月作成).
・東口高志:ナーシングQ&A 全科に必要な栄養管理Q&A、総合医学社(2005年).
|トップページ|脂質と血栓の関係|ミニ医学知識|生化学の知識|医学の話題|小児科疾患|生命の不思議|リンク集|


