


グルタミンとグルタミン酸
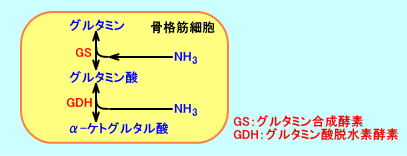
骨格筋細胞で、グルタミン酸(glutamic acid:Glu、塩は、glutamate)は、グルタミン(glutamine:Gln)と、相互に、変換される。
小腸では、グルタミンや、グルタミン酸は、代謝燃料として、重要な役割を果たしている。
小腸では、グルタミン酸、グルタミン、アスパラギン酸は、吸収された細胞内で、分解(異化:catabolize)され、その結果、アンモニア、アラニン、シトルリン(citrulline)、プロリン(proline)、二酸化炭素、乳酸が、生成される。
食事中(食餌中)のグルタミン、グルタミン酸、アスパラギン酸は、小腸で吸収され、小腸粘膜で、代謝されるが、殆んど、(門脈)血中に入ること(腸以外の組織で利用されること)はない。
グルタミンやグルタミン酸は、代謝燃料として、小腸上皮細胞や腸管付属リンパ節細胞に、エネルギーを供給して、急性胃腸炎からの回復を、促進すると考えられる。
小腸の絨毛突起(じゅう毛突起)には、栄養を吸収する際に、腸内の細菌が、体の中(血液中)に入り込まないように、生体中の免疫細胞の約半分が、集合している。点滴を長期間行い、経口摂取さないで絶食させると、絨毛の高さが短くなり、全身の免疫力も低下してしまう。経口摂取で投与されたグルタミンは、小腸上皮細胞や腸管付属リンパ節細胞に、エネルギーを供給して、急性胃腸炎からの回復を、促進すると考えられる。
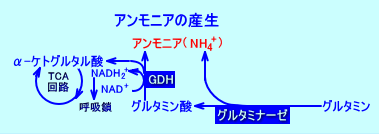
1.グルタミン酸脱水素酵素
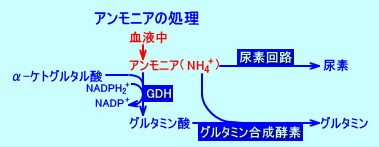
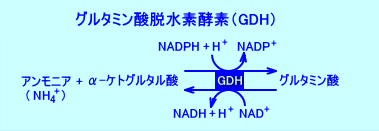
グルタミン酸(Glu)は、グルタミン酸脱水素酵素(グルタミン酸デヒドロゲナーゼ:glutamate dehydrogenase:GDH、または、GLDH)によって、アンモニア(NH3)とα-ケトグルタル酸(2-オキソグルタル酸)から生成される。
肝臓では、GDHによって、アンモニアが処理され、グルタミン酸が生成される。
アンモニア(NH4+)+α-ケトグルタル酸⇔L-グルタミン酸(Glu)
この反応は可逆的で、アンモニアとα-ケトグルタル酸から、グルタミン酸を生合成するのとは逆に、グルタミン酸を異化(nitrogen
liberation)して、アンモニアとα-ケトグルタル酸とに分解する異化反応も、GDHにより起こなわれる(運動時など)。しかし、平衡定数は、グルタミン酸を生合成する側に偏っている。
GDHは、グルタミン酸を生合成する際には、NADP+を補酵素に使用し、グルタミン酸を異化する際には、NAD+を補酵素に使用する(NADH2+が生成される)。
GDHによる、グルタミン酸の異化反応により、アミノ基(窒素)を集めたグルタミン酸から、尿素回路にアンモニアが供給されるだけでなく、TCA回路にα-ケトグルタル酸が、電子伝達系にNADH2+が、供給される。
ATPやGTPは、GDHによるグルタミン酸合成を促進し、ADPやGDPは、GDHによる異化反応(グルタミン酸分解)を促進させる。このようにして、ATP濃度が高い時(呼吸鎖によるエネルギー生成が十分な時)は、グルタミン酸のα-ケトグルタル酸への異化(アンモニアの生成)は、制限される。他方、エネルギー生成が不足している時(ADP濃度が高い時)は、グルタミン酸のα-ケトグルタル酸への異化は、促進させられる。
GDHにより生成されたグルタミン酸は、他のアミノ酸合成の際に、アミノ基を供与する。
植物や細菌では、GDHにより、グルコース(ブドウ糖)とアンモニアから、多量のアミノ酸の合成が可能。
GDHの大部分は、肝臓のミトコンドリア内(マトリックス)に存在する:GDHは、肝臓内に広く存在する。GDH(GLDH)は、肝小葉中心部の肝細胞(肝中心静脈-肝静脈周囲の肝細胞)に、限局して、存在する。血清中GDHは、肝炎、アルコール性肝障害、閉塞性黄疸など、肝細胞障害(肝細胞壊死)で、上昇する。
GDH(GLDH)は、多くは、肝臓(ミトコンドリア内)に存在する。GDHは、腎臓(尿細管細胞)、心筋、脳、腸のミトコンドリア内にも存在している。
血清中のGDH(GLDH)は、ミトコンドリア障害を伴なう肝細胞障害時に、上昇する。
血清中のGDH/ALT値(GLDH/ALT比)は、急性肝炎<慢性肝炎<肝硬変<鬱血肝(うっ血肝)の順に高くなる。GDHは肝静脈周囲に、ALTは門脈周囲に、それぞれ、多く存在すると言う。急性肝炎の多くは門脈周囲の肝細胞に障害が起こるが、慢性肝炎や肝硬変に進行すると門脈域から線維化が起こり、ALTはあまり上昇しなくなる。鬱血肝は、肝静脈周囲の肝細胞に障害が起こる。
血清中のGDH/OTC値(GLDH/OCT比)>0.6の場合は、肝小葉中心部の肝細胞障害(アルコール性肝障害、薬剤性肝障害)のことが多く、血清中のGDH/OTC値(GLDH/OCT比)<0.6の場合には、門脈周囲の肝細胞障害(ウイルス性肝障害)のことが多い(GDHは、肝小葉中心部の肝細胞に多く存在し、OTCは、門脈周囲の肝細胞に多く存在する)。

GDHには、ヒトでは、少なくとも、GDH1とGDH2と言う、2種類のタイプが存在する。
GDH1は、全ての組織に発現していて、GTPにより抑制され、ADPにより刺激される。GDH1の遺伝子は、GLUD1(グルタミン酸脱水素酵素遺伝子1)であり、染色体10q23.3に存在する。GLUD1が変異し、GTPによりGDH1が抑制されず、GDHの活性が亢進すると、高インスリン血性高アンモニア血症症候群が起こる。GDHの活性亢進の為、膵β細胞では、グルタミン酸からα-ケトグルタル酸への酸化反応が促進し、ATP産生が促進し、ATP/ADP比が上昇し、K依存性ATPチャネルが閉鎖し、電位依存性Ca2+チャネルが刺激され、インスリン放出が促進させられ、高インスリン血症になる(低血糖を来たす)。また、筋肉では、GDHによるα-ケトグルタル酸のグルタミン酸への還元反応が障害され、グルタミン合成酵素によるグルタミン酸とアンモニアから、グルタミンを生成する反応が低下し、高アンモニア血症になる。
GDH2は、神経組織、精巣組織、網膜にのみ発現している。GDH2の遺伝子は、GLUD2であり、X染色体に存在する。
2.グルタミン酸合成酵素
グルタミン(Gln)は、グルタミン酸合成酵素(glutamate synthase)によって、α-ケトグルタル酸(2-オキソグルタル酸)と反応し、2分子のグルタミン酸に変換される。
L-グルタミン(Gln)+α-ケトグルタル酸→2L-グルタミン酸(Glu)
この反応では、NADH2+が、消費される。
アラニン、AMPは、glutamine synthetaseの活性を抑制する(α-ケトグルタル酸を節約して、TCA回路を機能させる)。
3.グルタミン合成酵素とグルタミナーゼ
1).グルタミン合成酵素
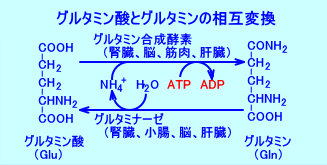
グルタミン合成酵素(glutamine synthetase、glutamine synthase:GS)は、グルタミン酸とアンモニアを結合させ、グルタミン(Gln)を生成する。
L-グルタミン酸(Glu)+アンモニア(NH4+)→L-グルタミン(Gln)
この反応には、ATP、Mg2+が必要。
この反応は、特に、脳でのアンモニアの解毒や、腎臓でのアンモニア排泄に、重要。
グルタミン合成酵素は、ミトコンドリアに存在し、腎組織に最も多く含まれている。
グルタミン合成酵素は、グルタミン(Gln)を生成する。グルタミンは、ヒトを含めた動物の血液中で、主要なアミノ酸。
生体は、神経毒性があり、血液をアルカリ化させるアンモニアを、毒性のないグルタミンと言うアミノ酸として、各組織(脳、骨格筋など)から各組織(腎臓、小腸など)へ輸送する:グルタミンは、末梢組織から、主に、腎臓へ、アンモニアを輸送する。
グルタミン合成酵素は、アンモニアをグルタミン酸と結合させ、グルタミンにすることで、神経毒性のあるアンモニアを、無毒化させる。
肝硬変など慢性肝不全では、門脈体循環短絡路(portacarval shunt)により、門脈血中のアンモニアが、肝臓を経ないで、直接、体循環(静脈血)に、入る。そのような場合、骨格筋では、グルタミン合成酵素の活性が高まり、血液(動脈血)中のアンモニアを、無毒化させる(肝臓、大脳皮質、小脳では、グルタミン合成酵素の活性が、低下する)。
2).グルタミナーゼ
グルタミナーゼ(glutaminase:GA)は、グルタミンを、グルタミン酸とアンモニアとに分解(deamidation)する。
グルタミナーゼには、腎臓型グルタミナーゼ(KGA)と、肝臓型グルタミナーゼ(LGA)の2種類が存在する。腎臓型グルタミナーゼは、腎臓、小腸、白血球、脳などに広く存在し、肝臓型グルタミナーゼは、肝臓にのみ存在する。
腎臓は、正常な酸塩基平衡状態では、血漿中のグルタミンを殆んど取り込まない(注1)。しかし、代謝性アシドーシスの状態では、1回、腎臓を血液が流れる間に、血漿中のグルタミンの1/3が取り込まれ、近位尿細管(proximal convoluted tubule)のミトコンドリア内に輸送され、グルタミナーゼや、GDHにより、分解される。代謝性アシドーシスの状態では、近位尿細管の尿細管腔側の(apical)のNHE(Na+/H+ exchanger)が活性化され、尿中へのH+排泄が、増加する。H+排泄と交換に再吸収されるNa+は、血管側(基底膜側:basal)のNa+-HCO3-共輸送系で、血液中に、取り込まれる。
グルタミンは、腎臓で、グルタミナーゼ(glutaminase)により分解され、アンモニア(NH3)が分離し、尿中のH+と結合して、NH4+として、尿中に排泄される(注2)。なお、腎臓では、グルタミナーゼ(glutaminase)によりアンモニア(NH3)が生成されるので、腎臓から出る腎静脈血中のアンモニア濃度は、腎動脈血中のアンモニア濃度より高い。また、グルタミンのグルタミナーゼによる分解(deamidation)により生成されたグルタミン酸は、さらに、GDHにより、α-ケトグルタル酸と、アンモニアとに分解(deamination)される。α-ケトグルタル酸は、リンゴ酸に変換され、ミトコンドリア外に輸送され、糖新生により、グルコースが生成される。
慢性の代謝性アシドーシスでは、動脈血中のグルタミン濃度は、正常の70%に低下する。腎臓では、グルタミナーゼ、GDH、PEPCK、NHE、Na+-HCO3-共輸送系の遺伝子の発現が、増加する。
3〜5日間以上の慢性アシドーシスでは、グルタミナーゼの活性が増大し、アンモニア生成量が、徐々に増加する。
肝臓型グルタミナーゼは、アンモニアによって、活性化される。
肝臓型グルタミナーゼの活性は、糖尿病、飢餓、高蛋白食で上昇し、低蛋白食では、低下する。
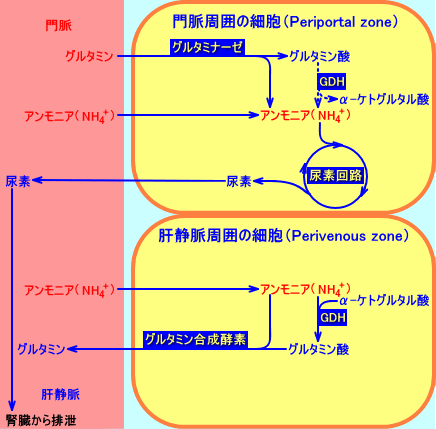
肝臓では、グルタミン合成酵素と、グルタミナーゼの両者は、別の細胞区画(different
cellular segments)に含まれている:グルタミン合成酵素は、肝静脈周囲(perivenous)の細胞に存在し、グルタミナーゼは、門脈周囲(periportal)の細胞に存在する。肝臓は、グルタミン合成酵素によりグルタミンを産生したり、グルタミナーゼにより、グルタミンを消費する(注3)。
尿素回路の酵素は、グルタミナーゼを含む、門脈周囲の肝細胞に、存在する。
肝臓では、グルタミンをグルタミナーゼで分解して、グルタミン酸やアンモニアを生成する。グルタミン酸は、尿素回路で使用されるアスパラギン酸の前駆体となり、アンモニアは、尿素回路で、尿素に代謝される。
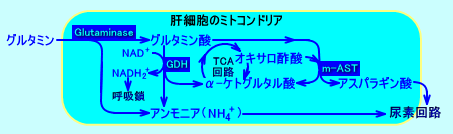
また、肝臓では、アンモニアをグルタミン合成酵素でグルタミンにして、腎臓に輸送する。腎臓では、グルタミンを、グルタミナーゼにより分解し、さらに、グルタミン酸をGDHにより分解しアンモニアを生成させ、アンモニアイオン(NH4+)を腎臓から排泄させる。
グルタミン酸とグルタミンは、グルタミン合成酵素とグルタミナーゼにより、相互に変換される。
4.グルタミン酸は、窒素の異化にも、同化にも重要な中間体
グルタミン酸は、グルタミンを合成してアンモニアを処理する際(アミノ酸同化)にも、アンモニアを尿素回路へ供給する際(アミノ酸異化)にも、中間体として、関与する。
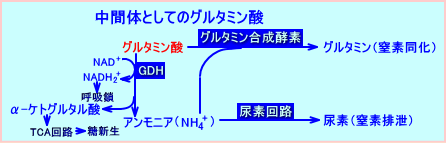
グルタミン酸は、窒素を異化する窒素排泄(nitrogen elimination)の経路と、窒素同化の経路(anabolic pathways)とで、主要な中間体(prominent intermediate)となる。
グルタミン酸は、窒素排泄の経路では、窒素を供給し(nitrogen donor)、肝臓のGDHで酸化的脱アミノ化され、アンモニアを生成する。逆に、グルタミン酸は、窒素同化の経路では、窒素を供給され(nitrogen acceptor)、グルタミン合成酵素(glutamine synthase)により、グルタミンに変換(convert)される。グルタミンは、腎臓の尿細管細胞に輸送され、グルタミナーゼやGDH(glutamate
dehydrogenase)により脱アミノ化される。
この、腎臓で、グルタミンが、グルタミナーゼやGDHによる脱アミノ化される際に、アンモニアが産生(生成)され、アンモニウムイオン(NH4+)として尿中に排泄される。アンモニウムイオンの排泄は、尿をアルカリ化し、尿のpHを正常(pH4〜pH8)に維持する。腎臓で生成されるアンモニア(NH3)は、アミノ酸の脱アミノ反応により生成されるが、約50%は、グルタミンに由来する。その他、グリシン、アラニン、セリンなどからも、アンモニアが生成される。

末梢組織、腸管内、肝臓(GDHによる)で、アンモニアが多量に産生されると、神経毒性や、アルカローシスが、現れる。
GDHとグルタミン合成酵素(glutamine synthatase)は、総ての微生物(organisms)に存在し、アンモニアをグルタミン酸やグルタミンに変換するのに有用。
5.小腸のグルタミンとグルタミン酸
小腸では、グルタミンや、グルタミン酸は、代謝燃料(metabolic fuels)として、重要な役割を果たしている。
食事中(食餌中)のグルタミン、グルタミン酸、アスパラギン酸は、小腸で吸収され、小腸粘膜で、代謝されるが、殆んど、(門脈)血中に入ること(腸以外の組織で利用されること)はない。小腸(rat)では、動脈血中のグルタミンの25-33%を取り込む。この量は、体全体のグルタミン消費量の30%に相当する。グルタミンと対照的に、動脈血中のグルタミン酸やアスパラギン酸は、小腸では、それ程、取り込まれない。しかし、腸管内(食餌由来)のグルタミン酸やアスパラギン酸は、小腸粘膜で、グルタミン同様に、代謝される。小腸の空腸では、腸管内腔(食餌由来)のグルタミンの66%、グルタミン酸の98%、アスパラギン酸の99%以上が、吸収され、小腸粘膜で、代謝される。従って、食餌(食事)で摂取した、多くのグルタミン、そして、殆んど総てのグルタミン酸やアスパラギン酸は、血中に入ること(腸以外の組織で利用されること)はない(注4)。グルタミン酸やアスパラギン酸は、食餌のうまみ成分。グルタミン酸やアスパラギン酸は、食餌のうまみ成分。アミノ酸でも、グルタミン酸ナトリウム塩やイノシン酸ナトリウム塩は、うまみ(うま味)成分であり、アラニン、グリシン、セリンは、あまみ(甘味)成分(注5)。
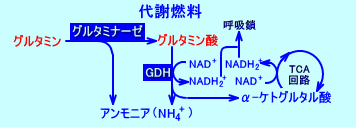
グルタミンは、小腸の粘膜グルタミナーゼにより、グルタミン酸と、アンモニアとに分解される。
小腸で、グルタミンの窒素は、37.9%がアンモニアに、27.6%がシトルリンに、24.4%がアラニンに、7.2%がプロリン(proline)に、代謝される。小腸では、グルタミン酸やアスパラギン酸の窒素は、アミノ基転移に使用され、ほとんど、アンモニアに、代謝されない。
小腸で、腸管内(食餌由来)のグルタミンの炭素は、56%が二酸化炭素に、16%が乳酸に、4%がアラニンに、2.4%がグルコースに代謝される。グルタミン酸の炭素は、64%が二酸化炭素に、16%が乳酸に、3.3%がアラニンに、代謝される。アスパラギン酸の炭素は、51%が二酸化炭素に、20%が乳酸に、8%がアラニンに、10%がグルコースに代謝される。
小腸で産生される二酸化炭素は、38%が、動脈血中から取り込まれたグルタミンに由来し、39%が、腸管内(食餌由来)のグルタミンとグルタミン酸とアスパラギン酸に由来し、6%が、腸管内(食餌由来)のグルコースに由来する。このように、小腸粘膜では、グルコースよりも、アミノ酸の方が、代謝燃料になる。
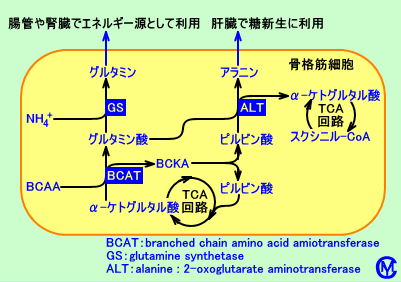
腸管組織には、GDHも、BCAT(branched-chain aminotransferase)も、存在する。
グルタミン酸は、GDHにより、脱アミノ化されるか、BCATによりアミノ基転移される:グルタミン酸が、GDHにより、脱アミノ化(分解)されると、α-ケトグルタル酸(AKG)と、アンモニアとが、生成される。グルタミン酸が、BCATによりアミノ基転移されると、BCKA(branched-chain  -keto acid)にアミノ基が渡され、α-ケトグルタル酸(AKG)と、相応するBCAA(branched-chain amino acid)が、生成される。
-keto acid)にアミノ基が渡され、α-ケトグルタル酸(AKG)と、相応するBCAA(branched-chain amino acid)が、生成される。
このように、グルタミン酸が、GDHやBCATにより分解され、α-ケトグルタル酸(AKG)が生成される。生成されたα-ケトグルタル酸(AKG)は、(腸管粘膜で)TCA回路で代謝され、燃料(エネルギー源)となる。また、GDHによりグルタミン酸が分解される時、NADH2+が生成され、呼吸鎖で、ATPが生成される。このように、グルタミン酸や、グルタミン酸を生成するグルタミンは、腸管粘膜で、代謝燃料(metabolic fuels)として利用される。
GDHの反応は可逆的で、α-ケトグルタル酸(AKG)とアンモニアから、グルタミン酸を生成し、アンモニアを処理する。α-ケトグルタル酸(AKG)は、アンモニアを、GDHによりグルタミン酸に変換することで、腸内で生成(産生)されたアンモニアを、処理する(没収する:sequester)ことに、役立ち得る。しかし、動物(young
pigs)を用いた実験結果では、α-ケトグルタル酸(AKG)を、経口投与しても、α-ケトグルタル酸(AKG)は吸収されるが、門脈中のアンモニア濃度は、低下しなかった。
なお、食事(食餌)後に、食物の窒素(dietary nitrogen)は、腸(gut)から、アンモニアとして(血中に)放出される。そのアンモニアの内、かなりの量は、GDHにより、グルタミン酸が脱アミノ化され、生成されるアンモニアである。
小腸では、グルタミン酸、グルタミン、アスパラギン酸は、吸収された細胞内で、分解(異化:catabolize)され、その結果、アンモニア、アラニン、シトルリン(citrulline)、プロリン(proline)、二酸化炭素、乳酸が、生成される。
食事(食餌)で摂取されたグルタミン酸は、極一部しか、循環血中に現れず、アラニンに変換される。
腸管粘膜で行われる、腸内(食事由来)のグルタミン酸代謝は、動脈血由来のグルタミン代謝より、盛んに行われる。
腸の粘膜で行われるグルタミン代謝量は、体内のグルタミン代謝(turnover)の30%に相当する。
御粥と、味噌汁(人参の上澄み入り) も、小腸の機能を高めるグルタミン酸を含んでいて、急性胃腸炎の幼若小児に食べさせる食品として、好ましい。
欧米では、アミノ酸(グルタミン、アラニン、グリシン)、オリゴ糖、可溶性の線維成分、核酸などを入れたORSも、臨床で使用されていると言う。
小腸の絨毛突起(じゅう毛突起)には、栄養を吸収する際に、腸内の細菌が、体の中(血液中)に入り込まないように、生体中の免疫細胞の約半分が、集合している。点滴を長期間行い、経口摂取さないで絶食させると、絨毛の高さが短くなり、全身の免疫力も低下してしまう。経口摂取で投与されたグルタミンは、小腸上皮細胞や腸管付属リンパ節細胞に、エネルギーを供給して、急性胃腸炎からの回復を、促進すると考えられる。
なお、グルタミンとアラニンを経口投与すると、アルコールの代謝(分解)が促進されるという。
6.アミノ基転移酵素

2-オキソ酸とは、2位炭素に、ケトン基を有する有機酸。2-オキソ酸には、オキサロ酢酸、ピルビン酸、α-ケトグルタル酸(2-オキソグルタル酸)などがある。
グルタミン酸のアミノ基を、オキサロ酢酸にアミノ基転移する酵素は、AST(別名、GOT):
グルタミン酸+オキサロ酢酸⇔2-オキソグルタル酸+アスパラギン酸
グルタミン酸のアミノ基を、ピルビン酸にアミノ基転移する酵素は、ALT(別名、GPT):
グルタミン酸+ピルビン酸⇔2-オキソグルタル酸+アラニン
グルタミン酸(Glu)とグルタミン(Gln)は、糖原性アミノ酸であり、ミトコンドリア内で、m-AST(m-GOT)により、2-オキソグルタル酸(α-ケトグルタル酸)になり、TCA回路(クエン酸回路)に入る。
トリプトファン(Trp)、アラニン(Ala)、AMPなどは、グルタミン合成を抑制する(glutamine synthetaseの活性を抑制する)。
なお、アンモニウムイオン(NH4+)は、脳血液関門を通過しにくいが、アンモニア(NH3)は、脳神経細胞内に移行しやすい:NH4+は、難脂溶性だが、NH3は、脂溶性であり、細胞膜を通過し、細胞内に移行し、細胞障害毒性(神経毒性)を発揮する。
7.母乳中のグルタミン酸
母乳中には、カゼイン、α-ラクトアルブミンなどの蛋白質の他に、グルタミン酸などの遊離アミノ酸や、尿素など、非蛋白態窒素成分が含まれている。
母乳中の遊離アミノ酸濃度(mg/100ml)は、泌乳期により、変化する。母乳中の遊離アミノ酸濃度は、初乳より、成乳の方が、濃くなる。
母乳中のグルタミン酸濃度や、グルタミン濃度は、初乳より、成乳の方が、濃くなる。
母乳中のグルタミン酸や、タウリン(や、ホスホエタノールアミン)は、新生児の消化機能を補うエネルギー源となる。
表1 泌乳期による遊離アミノ酸と尿素含量の変化(mg/100ml)
泌乳期
(日) |
初乳
3〜5 |
成乳
31〜60 |
成乳(後期)
121〜240 |
| グルタミン酸 |
15.92 |
20.94 |
26.79 |
| グルタミン |
0.31 |
3.66 |
8.27 |
| タウリン |
5.93 |
4.22 |
3.76 |
| アラニン |
2.06 |
2.12 |
3.07 |
| セリン |
0.97 |
1.27 |
1.81 |
| スレオニン |
1.26 |
1.02 |
1.46 |
| その他 |
15.00 |
8.98 |
10.10 |
| 総遊離アミノ酸 |
41.45 |
42.21 |
55.26 |
| 尿素 |
39.01 |
34.82 |
43.82 |
| 総合計 |
81.06 |
77.52 |
99.63 |
8.脳とグルタミン酸
グルタミン酸は、脳内の情報伝達に関与している。グルタミン酸は、興奮性神経伝達物質として機能する。
脳神経細胞内では、グルタミン酸から、グルタミン酸脱炭酸酵素(glutamic
acid decarboxylase:GAD)により、抑制性の神経伝達物質のGABA(γ-aminobutyric acid:ガンマ-アミノ酪酸)が、生成される。
マウスの実験では、胎児は、脳内から不要になったグルタミン酸を排出出来ないと、グルタミン酸が、脳内に蓄積し、脳形成に障害を起こす(大脳皮質、海馬、扁桃体、小脳の形成が異常になる)と考えられている。
9.その他
・グルタミン(glutamine:Gln)は、骨格筋、肺、脳、心筋などで生成され、消化管(粘膜上皮)、腎臓、肝臓、白血球、繊維芽細胞などで、エネルギー源として利用される。グルタミンは、肝臓(や腎臓)では、糖新生の基質としても利用される。
グルタミンは、小腸や大腸の重要なエネルギー源となる。グルタミンは、腸管粘膜の萎縮を予防し、腸管からのbacterial
translocationを防ぐ。
グルタミンは、蛋白分解抑制作用(蛋白節約効果)がある。
・グルタミンは、腸管や腎臓での主要なエネルギー源(栄養素)となる。
グルタミンは、筋組織(骨格筋細胞)で生成され(30g/日)、腸管や腎臓で利用される。
表2 食品中のBCAA含量(可食部100g当たりの含量:五訂食品成分表2005より引用)
| 食品名 |
蛋白質 |
分岐鎖アミノ酸(BCAA) |
芳香族アミノ酸(AAA) |
BCAA/AAA比 |
その他 |
| Val |
Leu |
Ile |
合計 |
Phe |
Tyr |
Trp |
合計 |
mg比 |
Fischer比 |
Ala |
Glu |
Met |
| g |
mg |
mg |
mg |
mg |
mg |
mg |
mg |
mg |
ratio |
ratio |
mg |
mg |
mg |
| 糸引納豆 |
16.5 |
830 |
1300 |
760 |
2890 |
870 |
680 |
240 |
1790 |
1.615 |
2.528 |
680 |
3200 |
260 |
| 木綿豆腐 |
6.8 |
380 |
600 |
370 |
1350 |
390 |
290 |
100 |
780 |
1.731 |
2.686 |
320 |
1300 |
100 |
| 凍り豆腐 |
50.2 |
2900 |
4600 |
2800 |
10300 |
3000 |
2200 |
760 |
5960 |
1.728 |
2.679 |
2400 |
9700 |
790 |
| 精白米 |
6.8 |
430 |
570 |
290 |
1290 |
370 |
280 |
99 |
749 |
1.722 |
2.702 |
390 |
1300 |
170 |
| 食パン市販 |
8.4 |
400 |
660 |
340 |
1400 |
460 |
240 |
96 |
796 |
1759 |
2.687 |
270 |
3100 |
150 |
| うどん生 |
6.8 |
300 |
510 |
260 |
1070 |
370 |
200 |
75 |
645 |
1.659 |
2.522 |
260 |
2600 |
120 |
| ごま乾 |
19.8 |
1100 |
1500 |
840 |
3440 |
1000 |
770 |
370 |
2170* |
1.585 |
2.643 |
1000 |
4000 |
720 |
| さんま生 |
20.6 |
1100 |
1600 |
950 |
3650 |
830 |
690 |
230 |
1730* |
2.110 |
3.265 |
1200 |
2800 |
660 |
| まぐろ赤身生 |
28.3 |
1400 |
2100 |
1300 |
4800 |
1000 |
920 |
320 |
2220* |
2.162 |
3.403 |
1500 |
3700 |
810 |
| 豚ひき肉 |
18.2 |
870 |
1300 |
770 |
2940 |
650 |
500 |
200 |
1400* |
2.100 |
3.467 |
1100 |
2500 |
440 |
| 若鶏むね皮なし |
22.9 |
1200 |
1900 |
1200 |
4300 |
960 |
820 |
280 |
2080* |
2.067 |
3.278 |
1400 |
3700 |
660 |
| 若鶏もも皮なし |
18.0 |
920 |
1500 |
880 |
3300 |
740 |
620 |
210 |
1610* |
2.050 |
3.291. |
1100 |
2900 |
530 |
| 鶏卵全卵生 |
12.3 |
830 |
1100 |
680 |
2610 |
640 |
500 |
190 |
1290* |
2.023 |
3.114 |
700 |
1600 |
400 |
| 牛乳生乳 |
2.9 |
190 |
280 |
150 |
620 |
140 |
110 |
38 |
288 |
2.153 |
3.369 |
93 |
560 |
75 |
| プロセスチーズ |
22.7 |
1600 |
2300 |
1200 |
5100 |
1200 |
1300 |
290 |
2790 |
2.153 |
2.794 |
670 |
5000 |
580 |
| たらこ生 |
24.9 |
1600 |
2500 |
1500 |
5600 |
1000 |
1100 |
300 |
2400 |
2.333 |
3.642 |
1900 |
3200 |
560 |
| しじみ生 |
6.8 |
360 |
460 |
300 |
1120 |
280 |
220 |
90 |
590 |
1.898 |
3.048 |
540 |
830 |
180 |
| ほうれんそう生 |
3.3 |
120 |
170 |
95 |
385 |
120 |
88 |
53 |
263* |
1.464 |
2.512 |
110 |
300 |
29 |
*:芳香族アミノ酸(AAA)の項の合計量で、*印を上付きに表示した食品は、五訂食品成分表2005で、芳香族アミノ酸(AAA)の合計量が、フェニルアラニン(Phe)と、チロシン(Tyr)の数値を足した値と異なっている。
・アルギニン(arginine)は、準必須アミノ酸なので、高カロリー輸液(IVHなど)に際して、補給が必要。
アルギニンは、蛋白分解抑制作用(蛋白節約効果)がある。
アルギニンは、肝臓の尿素回路での尿素合成、一酸化窒素(NO)、ポリアミンの合成、免疫機能の増強、内分泌(ホルモン産生)の刺激に必要。
アルギニンは、臓器修復促進作用がある。
アルギニンは、血流改善作用がある(NO産生に必要)。
アルギニンは、代謝されてグルタミンに変換される。
・グルタミン、アルギニン、BCAA(分岐鎖アミノ酸)、n-3系多価不飽和脂肪酸、核酸、食物繊維、亜鉛などの栄養素は、免疫機能を増強する作用がある(immunonutrition)。
・グルタミンは、腸管免疫能を増強させる。
小腸の粘膜細胞の主要なエネルギー源であるグルタミンは、小腸粘膜を保護する(小腸の粘膜上皮を増殖させる)。
グルタミンは、免疫担当細胞(マクロファージ、好中球、リンパ球など)の主要なエネルギー源ともなる。
長期の飢餓(絶食)は、小腸粘膜上皮を萎縮させ、GALTなどによるバリア機能が低下させてしまう。その結果、腸管内腔の細菌や細菌菌体毒素(エンドトキシン)が、血液中に移行し易くなる(バクテリアルトランスロケーション)。
長期の飢餓(絶食)に陥った患者には、GFO療法が有用と言われる。GFO療法では、グルタミン(G)9g/日、水溶性ファイバー(F)15g/日、オリゴ糖(O97.5g/日を、少量の水に溶解させ、3回に分けて、経口投与か経腸投与する。
水溶性ファイバー、オリゴ糖は、ビフィズス菌(ビフィドバクテリウム属)、乳酸菌(ラクトバチルス属)など有用な腸内細菌を増加させ、バクテロイデス属など有害な腸内細菌を減少させる。水溶性ファイバーは、腸管の絨毛を進展させ、(腸内細菌による)短鎖脂肪酸(酪酸、酢酸など)を腸管内腔に増加させ、腸機能を高める。
・血中(動脈血中)にグルタミンやアルギニンなどのアミノ酸量(絶対量)が減少すると、腸管の各種消化酵素の生成が障害され、吸収障害が悪化する。
・グルタミン酸は、C(炭素)5個と、N(窒素)1個とから構成されているので、C/N比は、5と高く、糖質の生成に関与し、生殖生長的に作用する。
アルギニンは、C(炭素)6個と、N(窒素)4個とから構成されているので、C/N比は、1.5と低く、根や葉を伸ばし、栄養成長的に作用する(アルギニンは低カロリー)。
酵母菌(通性嫌気性菌)は、酸素をあまり消費せず(嫌気性環境でも)、長時間をかけてアミノ酸を合成するので、高カロリーなアミノ酸(C/N比が高いアミノ酸:プロリンなど)が合成される。
納豆菌は、好気性環境で、短時間でアミノ酸を合成するので、低カロリーなアミノ酸(C/N比が低いアミノ酸:アルギニンなど)が合成される。
注1:腎動脈中のグルタミンの20%は、糸球体で濾過され、近位尿細管の上皮細胞で再吸収される。その為、正常では、血漿中グルタミン濃度は、腎動脈と腎静脈とでは、差がない。
注2:グルタミンが、グルタミナーゼにより分解され、生成されるグルタミン酸は、さらに、GDHにより分解され、α-ケトグルタル酸が、生成され、TCA回路で、エネルギー源になる(グルタミンの10〜30%は、TCA回路のエネルギー源となる)。また、グルタミン酸は、m-AST(m-GOT)によりアスパラギン酸(尿素回路で利用される)、ALT(GPT)によりアラニンに、変換される。
注3:肝臓は、循環血中(門脈血中)より、アンモニアとグルタミンを、取り込む。
門脈周囲の細胞(periportal cells)内で、グルタミンは、グルタミナーゼにより分解され、その結果生成されるアンモニアは、循環血中を肝臓に流れて来たアンモニアと共に、尿素回路で、尿素に変換される。
循環血中を肝臓に流れて来たアンモニアは、門脈周囲の細胞(periportal cells)内で処理されないと、肝静脈周囲の細胞(perivenous
cells)で、グルタミン合成酵素により、グルタミンに変換される。
従って、肝臓は、アンモニアを取り込んで、尿素を排泄するが、(門脈血中と肝静脈血中で)グルタミンの濃度は、ほとんど変化しない。
注4:血漿中のアミノ酸濃度(μmol/L)は、下表の如く。
バリン(Val)、ロイシン(Leu)、イソロイシン(Ile)、トレオニン(Thr)、メチオニン(Met)、フェニルアラニン(Phe)、トリプトファン(Trp)、リジン(Lys)は、必須アミノ酸。幼児では、ヒスチジン(His)も、必須アミノ酸。
バリン(Val)、ロイシン(Leu)、イソロイシン(Ile)は、分岐鎖アミノ酸(BCAA)。フェニルアラニン(Phe)、チロシン(Tyr)、トリプトファン(Trp)は、芳香族アミノ酸(AAA)。肝不全(劇症肝炎や非代償性肝硬変)では、血漿アミノ酸濃度が変化して、BCAA(Val、Leu、Ile)濃度が低下し、AAA(Tyr、Phe、Trp)濃度や、メチオニン(Met)濃度が、増加する。
表3 血漿中、髄液中のアミノ酸濃度
| アミノ酸 |
血漿 |
髄液 |
| 酸性アミノ酸 |
グルタミン(Gln) |
596〜896 |
420〜580 |
| グルタミン酸(Glu) |
13〜61 |
4〜13 |
| アスパラギン酸(Asp) |
<6 |
2〜6 |
| アスパラギン(Asn) |
70〜140 |
<5 |
| 中性アミノ酸 |
アラニン(Ala) |
180〜528 |
12〜41 |
| バリン(Val) |
152〜322 |
9〜20 |
| ロイシン(Leu) |
98〜180 |
3〜15 |
| イソロイシン(Ile) |
44〜105 |
1〜8 |
| グリシン(Gly) |
130〜326 |
3〜18 |
| セリン(Ser) |
83〜196 |
15〜34 |
| トレオニン(Thr) |
80〜207 |
21〜41 |
| システイン(Cys) |
26〜71 |
<2 |
| メチオニン(Met) |
20〜44 |
<3 |
| フェニルアラニン(Phe) |
45〜88 |
2〜9 |
| チロシン(Tyr) |
47〜96 |
5〜21 |
| トリプトファン(Trp) |
37〜79 |
<3 |
| 塩基性アミノ酸 |
ヒスチジン(His) |
60〜124 |
6〜20 |
| アルギニン(Arg) |
62〜149 |
12〜29 |
| リジン(Lys) |
106〜288 |
10〜28 |
| オルニチン(Orn) |
32〜92 |
2〜8 |
| イミノ酸 |
プロリン(Pro) |
109〜281 |
<3 |
注5:舌が知覚する味覚には、甘味(あまみ:Sweatness:エネルギー源を識別)、酸味(さんみ:Sourness:エネルギー源、腐敗物、刺激物を識別)、塩味(えんみ:saltiness:ミネラルを識別)、苦味(にがみ:bitterness:毒物を識別)、旨味(うまみ:umami:蛋白合成材料を識別)の基本味がある。その他、舌は、辛味(からみ)、渋味(しぶみ)、えぐ味(えぐみ)、温度を知覚する。
スクロース(ショ糖)、フルクトース(果糖)は、甘味として知覚される。
L-アミノ酸(19種類)とグリシンは、旨味として知覚されるが、イノシン酸(IMP)やグアニル酸(GMP)は、旨味を増強させる。
アミノ酸のL-グルタミン酸は、旨味として、L-アラニンは、甘味として、L-ロイシンは、苦味として、それぞれ、知覚される。
甘味、苦味、酸味は、味細胞の異なる受容体に結合したG蛋白(Gαi2)を介して、ホスホリパーゼC系(PLC)を活性化させ、小胞体のCa2+チャネルからCa2+を放出させ、活動電位が生じる。
参考文献
・ハーパー・生化学(原著14版、三浦義彰監訳、丸善株式会社、 1975年).
・ヴォート基礎生化学(東京化学同人、第1版第4刷、2003年).
・鈴木紘一、他:ホートン生化学 第3版(東京化学同人、2005年、第3刷).
・香川芳子:五訂食品成分表2005(女子栄養大学出版部、2005年).
・内科 61巻6号(1988-6) 61:1105.
・母乳中に20%も含まれる非蛋白態窒素成分 スポット小児科医 No.6, 1992年(社団法人日本小児科学会広報委員会).
・上松あゆ美、他:高インスリン血性高アンモニア血症症候群 小児科 Vol.41
No.3. 391-396頁、2000年.
・高瀬修二郎、土屋睦:グルタミン酸脱水素酵素(GLDH)、最新 臨床検査のABC、日本医師会雑誌 第135巻・特別号(2)、生涯教育シリーズ−70、S115頁、平成18(2006)年10月.
・磯部泰弘:科学 骨破壊抑えるグルタミン酸、信濃毎日新聞、2006年(平成18年)10月16日(月曜日)、11面.
・東口高志:ナーシングQ&A 全科に必要な栄養管理Q&A、総合医学社(2005年).
・谷口正哲:Q33 侵襲時・感染時の蛋白投与方法は?、ナーシングQ&A 全科に必要な栄養管理Q&A、70-71頁、総合医学社(2005年).
・飯田敏雄、伊藤彰博:Q50 長期の絶食はなぜいけないの?、ナーシングQ&A 全科に必要な栄養管理Q&A、108-109頁、総合医学社(2005年).
・Norman P. Curthoys (2001) Role of Mitochondrial Glutaminase in Rat Renal Glutamine Metabolism. he Journal of Nutrition 131:2491-2495.
・Peter J.Reeds (2000) Intestinal Glutamate Metabolism. The Journal of Nutrition 130:978-982.
・Guoyao Wu (1998) Intestinal Mucosal Amino Acid Catabolism. The Journal of Nutrition 128:1249-1252.
|トップページ|脂質と血栓の関係|ミニ医学知識|生化学の知識|医学の話題|小児科疾患|生命の不思議|リンク集|



-keto acid)にアミノ基が渡され、α-ケトグルタル酸(AKG)と、相応するBCAA(branched-chain amino acid)が、生成される。