





リポ蛋白リパーゼ(LPL)
【ポイント】
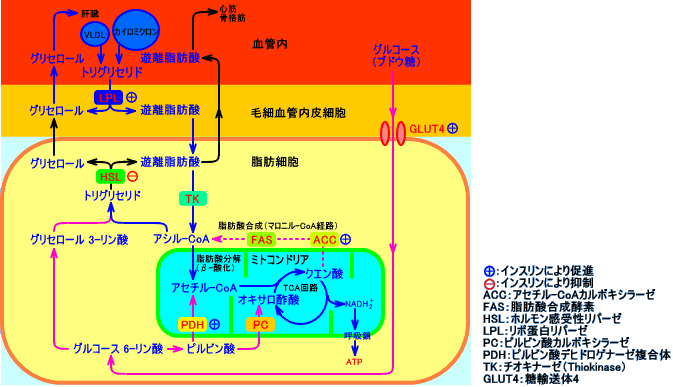
リポ蛋白リパーゼ(LPL)は、脂肪組織などで合成・分泌され、毛細血管の血管内皮細胞表面(脂肪細胞外)に存在する。リポ蛋白リパーゼ(LPL)は、細胞外で、血液中の中性脂肪(トリグリセリド)を、遊離脂肪酸とグリセロールに分解し、細胞内(脂肪細胞内など)に、遊離脂肪酸を取り込ませる。脂肪細胞では、リポ蛋白リパーゼ(LPL)により分解されて取り込まれた遊離脂肪酸は、アシル-CoAを経て、中性脂肪に再合成され、貯蔵される(LPLは、脂肪細胞の中性脂肪貯蔵を促進する)。
なお、ホルモン感受性リパーゼ(HSL)は、脂肪細胞内に存在して、トリグリセリドを、遊離脂肪酸とグリセロールとに分解し、遊離脂肪酸を、血液中に、放出させる(HSLは、脂肪細胞の中性脂肪分解を促進する)。
インスリンは、脂肪組織(脂肪細胞外の血管内皮細胞表面)のリポ蛋白リパーゼ(LPL)の活性をは、上昇させる(脂肪細胞内の中性脂肪貯蔵を促進する)。インスリンは、筋肉、特に心筋のLPL活性をは、低下させる。インスリンは、脂肪細胞に作用し、グルコースの取り込みを促進させ、グリセロール
3-リン酸を生成させ、脂肪細胞が、遊離脂肪酸を、中性脂肪として貯蔵することを、促進する。
インスリンは、ホルモン感受性リパーゼ(HSL)の活性をは、低下させる(脂肪細胞内の中性脂肪分解を抑制する)。
インスリンは、血漿中のリポ蛋白中の中性脂肪の分解を促進し(LPL活性上昇)、遊離脂肪酸を、脂肪細胞内に取り込まさせ、また、脂肪細胞内の中性脂肪の分解を抑制し(HSL活性低下)、脂肪細胞の中性脂肪貯蔵量を増加させる(肥満を促進する)。
脂肪細胞は、インスリンの作用により、血液中のグルコース(ブドウ糖)を、細胞内に取り込んで、中性脂肪(トリグリセリド)を合成し、貯蔵する。
脂肪細胞は、血液中のVLDL(やレムナント)やカイロミクロンに含まれる中性脂肪がリポ蛋白リパーゼ(LPL)により分解されて生じる遊離脂肪酸を、細胞内に取り込んで、中性脂肪として再合成(再構成)し、貯蔵する。
リポ蛋白リパーゼ(LPL)は、トリグリセリド(中性脂肪)を、脂肪酸とグリセロールに分解する。
LPLは、広く、いろいろな組織(毛細血管壁)に存在しているが、脂肪組織で活性が最も高い。LPLは、心筋や骨格筋でも活性が高い。LPLは、肝臓、肺、腎臓(腎髄質)、脾臓、動脈、乳腺、マクロファージにも存在する。LPLは、末梢血管、特に、脂肪組織に血液を供給する細小動脈や毛細血管の内壁に存在する。LPLは、心臓、脂肪組織、脾臓、肺、腎髄質、動脈、横隔膜、乳腺などの組織抽出液にも、含まれている。
LPLは、主に、脂肪組織や、心筋や骨格筋で合成され、分泌され、毛細血管の血管内皮細胞表面で、ヘパラン硫酸などのプロテオグリカンに結合して、存在する(係留している)。
LPLの活性化には、アポ蛋白のアポC-IIが、補酵素のように働くことが、必要。アポC-IIが欠損すると、LPL欠損症と同じような症状を呈する。アポC-IIIは、LPL活性を抑制する。
LPLは、脂肪細胞および筋細胞で合成され、不活性型として分泌され、脂肪組織や筋肉の毛細血管内皮細胞表面に、存在する。なお、ホルモン感受性リパーゼ(HSL)は、細胞内に存在する。
LPLは、カイロミクロンやVLDLに含まれる、アポC-IIと言うアポ蛋白により、活性化され、カイロミクロンやVLDLのトリグリセリド(中性脂肪)を、脂肪酸とグリセロール(モノグリセライド)とに、加水分解する。
カイロミクロンやVLDLに含まれるトリグリセリド(中性脂肪)が、LPLにより分解されると、より粒子が小さなリポ蛋白となり、カイロミクロンレムナントやIDLが、生じる。
LPLは、脂肪組織の毛細血管内皮細胞表面に存在し、血液中のリポ蛋白(回路ミクロンやVLDL)のトリグリセリドを分解し、脂肪酸を脂肪細胞に取り込まさせる。他方、HSLは、脂肪細胞内に存在し、脂肪細胞中のトリグリセリドを分解し、血液中に脂肪酸を放出(供給)させる。
脂肪組織では、LPLにより分解した脂肪酸を、再び、トリグリセリドとして、貯蔵する。脂肪組織以外の組織(心筋や骨格筋など)では、LPLにより分解した脂肪酸を、エネルギー源として利用する。
インスリンは、脂肪組織(脂肪細胞外の血管内皮細胞表面)のリポ蛋白リパーゼ(LPL)の活性をは、上昇させる。インスリンは、脂肪組織のLPL(脂肪細胞外の血管内皮細胞表面に存在する)の活性をは、上昇させるので、LPLによって血液中の中性脂肪が分解され、遊離脂肪酸の脂肪細胞内への取り込みが促進され、中性脂肪貯蔵が促進する。
インスリンは、筋肉(特に心筋)のLPL活性をは、低下させる。
インスリンは、ホルモン感受性リパーゼ(HSL)の活性をは、抑制する。成長ホルモンは、脂肪組織のリポ蛋白リパーゼ(LPL)の活性を、抑制(低下)させる。
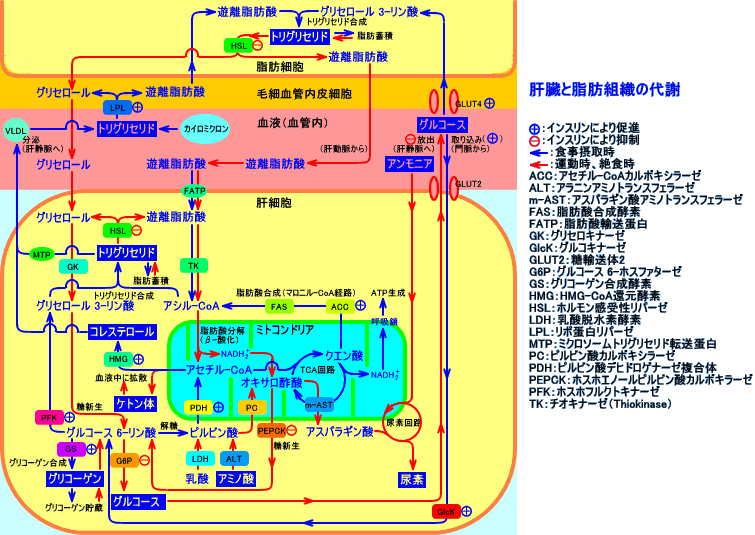
インスリンは、脂肪細胞内のトリグリセリド(中性脂肪)の分解を抑制し、血漿中のリポ蛋白中のトリグリセリド(中性脂肪)の分解を促進し、脂肪酸を、脂肪組織(脂肪細胞)内に取り込む。脂肪組織(白色脂肪細胞)では、glycerokinase(グリセロールを、グリセロール-3-リン酸にする酵素)の活性が低いので、LPLによりトリグリセリドが分解される際に、脂肪酸と同時に放出されるグリセロールは、血漿中を、肝臓に輸送される(糖新生に利用される)。
脂肪細胞では、遊離脂肪酸が、LPLによるカイロミクロンやVLDL内のトリグリセリドの分解や、HSLによる脂肪細胞内のトリグリセリドの分解により生成される。
脂肪細胞では、トリグリセリド合成に必要なアシル-CoAは、LPLにより生成された遊離脂肪酸や、グルコースが解糖されて生成されるアセチル-CoAから生成される:ヒトの脂肪細胞では、後者のアシル-CoA(グルコースが解糖されて生成されるアセチル-CoAから生成される脂酸)は、極めて少ない。脂肪細胞では、中性脂肪を合成する(組み立てる)が、中性脂肪の原料となる遊離脂肪酸(アシル-CoA)は、血中のカイロミクロンやVLDLの中性脂肪に由来し、脂肪細胞内で合成される遊離脂肪酸は、少ない(脂肪酸を合成する酵素活性は、肝臓が高い)。
脂肪細胞では、アシル-CoAと、グリセロール 3-リン酸(α-グリセロリン酸)から、トリグリセリドが生成される。グリセロール 3-リン酸は、インスリンにより脂肪細胞内に取り込まれるグルコース(ブドウ糖)の代謝(解糖)により、供給される。
glycerokinaseは、肝臓や腎臓に存在するが、脂肪細胞(白色脂肪細胞)には、glycerokinaseが存在しない(活性が低い)ので、HSLによりトリグリセリドが分解された際に生成されるグリセロールは、アシル-CoAをエステル化してトリグリセリドを生成するのに、利用出来ない。
脂肪細胞は、インスリンの作用で、糖輸送担体(GLUT4)の発現が促進され、グルコースを取り込み、グリセロール 3-リン酸を生成し、遊離脂肪酸を、トリグリセリドとして貯蔵する(インスリンの作用で肥満になる)。なお、脂肪組織に取り込まれるグルコース(ブドウ糖)は、(血糖の)3%程度に過ぎないと言う。
インスリンは、血漿中のリポ蛋白中の中性脂肪の分解を促進し(LPL活性上昇)、遊離脂肪酸を、脂肪細胞内に取り込まさせ、また、脂肪細胞内の中性脂肪の分解を抑制し(HSL活性低下)、脂肪細胞の中性脂肪貯蔵量を増加させる(肥満を促進する)。
インスリンが不足して、グルコースが脂肪細胞内に取り込まれないと、脂肪細胞内では、HSLによるトリグリセリド分解の方が、エステル化によるトリグリセリド合成(アシル-CoAのグリセロール 3-リン酸へのエステル化)より、多くなり、血中への遊離脂肪酸の放出が増加する。
カイロミクロンやVLDLは、含まれているアポC-II(HDLから獲得する)というアポ蛋白を介して、主に脂肪組織や筋肉の毛細血管内皮細胞表面のリポ蛋白リパーゼ(LPL)を活性化させる。LPLは、カイロミクロンを、カイロミクロンレムナントに変化させ、また、VLDLを、IDLに変化させる(IDLは、HTGLにより、LDLに変化させる)。
糖尿病では、血液中のLPL活性が低下し、中性脂肪の分解が遅延して、高中性脂肪(トリグリセリド)血症になる。
糖尿病では、VLDL、カイロミクロンレムナント、VLDLレムナント(IDL)が増加する。また、LDLの異化で生成されるHDL(特に、HDL2)が、低下する。NIDDMでは、門脈における高インスリン血症が、肝臓での脂肪酸合成を増加させ、VLDL合成を促進させ、LDLが増加する。
血糖の上昇により、LDLのアポB蛋白のリジン残基が糖化され、LDL受容体(LDLレセプター)
への親和性が低下し、LDLが血中に増加し、動脈硬化の原因となる、酸化LDLも増加する。
糖尿病では、小腸上皮細胞で、コレステロールの吸収を促進させるアシル-CoA:コレステロールアシルトランスフェラーゼ(ACAT:acyl-CoA cholesterol acyltransferase)の活性が増加していて、コレステロールを含んだカイロミクロンレムナントが増加しやすい。
リン脂質は、LPL活性を阻害する。
経静脈栄養に用いる脂肪乳剤は、10%製剤と、20%製剤とがあるが、20%製剤の方が、トリグリセリドが多く含まれているので、リン酸/トリグリセリド比が低く、投与されるリン脂質が、少ないので、LPL活性の阻害が少なく、トリグリセリドが、LPLにより、速く代謝される(LDL分画のコレステロールやリン脂質の沈着が低下する)。
LPLは、1943年に、Hahnが、イヌの実験中に、ヘパリンを抗凝固剤として使用した血液を輸血した際、食事性高脂肪血症により乳び状の外観を呈していたイヌの血漿が、清澄化される現象に気付き、清澄化因子(clearing
factor)として発見された。
ヘパリンを、血漿トリグリセリド値(血漿TG値)が正常な健常者に静注(静脈注射)すると、血漿LPL活性が増加して、トリグリセリドリッチリポ蛋白(カイロミクロンやVLDL)が、LPLにより分解され、血漿中HDL-コレステロール値(濃度)が、上昇する。
LPL活性は、ヘパリン静注前には、血漿中に殆ど検出出来ない。ヘパリン静注後には、LPLが血液中に遊離し、血漿LPL活性が増加する。なお、ヘパリン静注により、肝性トリグリセリドリパーゼ(HTGL)も血液中に遊離して来るので、分別定量が必要となる。
フィブラート系薬剤は、血中で、リポ蛋白リパーゼ(LPL)と、肝性トリグリセリドリパーゼ(HTGL)を活性化させ、VLDLやレムナントリポ蛋白の異化を促進する。
肥満患者では、脂肪細胞のLPL活性が高い。
参考文献
・河盛隆造:肝臓におけるインスリンの作用 日本医師会雑誌 第123巻・第9号 IS-05-08、2000年.
・肝疾患診療マニュアル、日本医師会雑誌特別号 Vol.122、No.8、1999年.
・門脇孝:糖尿病はなぜ起こるか−成因と病態 日本医師会雑誌 116: 1395-1400, 1996年.
・矢崎義雄、他:Vascular Biologyと冠動脈疾患の治療(日経メディカル開発、1996年).
・ヴォート生化学(東京化学同人、2003年、第4刷).
・ハーパー・生化学(丸善株式会社発行、1975年).
・丸浜喜亮:脂質パラメータのみかた 5.遊離脂肪酸 臨床医 vol.8, no.9,
22-23, 1982年.(Shrago, et al. : Comparative aspects of lipogenesis in
mammalian tissues. Metabolism, 20 : 54, 1971.)
・村勢敏郎:今日の医学 2.リポ蛋白リパーゼ vol.8, no.9, 58-60, 1982年.
・板橋家頭夫:低出生体重児 小児科 Vol.37, No.8, 905-916, 1996年.
・清島満:インスリンによるリポ蛋白リパーゼの制御(質疑応答) 日本醫事新報 No.4236(2005年7月2日)、91-92頁.
・菊池方利:肝における糖調節機構について 日本醫事新報 No.4184(2004年7月3日)、21-30頁.
・植田伸夫:脂肪酸代謝と肥満 小児科 31: 747-753, 1990年.
・石橋俊:リポ蛋白リパーゼ(LPL)、最新 臨床検査のABC、日本医師会雑誌 第135巻・特別号(2)、生涯教育シリーズ−70、S187頁、平成18(2006)年10月.
|トップページ|脂質と血栓の関係|ミニ医学知識|生化学の知識|医学の話題|小児科疾患|生命の不思議|リンク集|



