


絶食時の代謝
絶食時の糖質(炭水化物)、蛋白質、脂質の代謝をまとめました。
絶食時には、肝臓で、グリコーゲンを分解したり、筋肉から放出されるアミノ酸から糖新生をして、グルコース(ブドウ糖)が、血液中に供給され、血糖が維持されます。
脳は、エネルギー源として、グルコースに代わり、肝臓で脂肪酸から生成されるケトン体を使用するようになります。脳は、脂肪酸をエネルギー源として、使用出来ません。
絶食時には、カロリー源として、まず、糖質(グリコーゲン)が、分解され、消費され、次いで、脂質(脂肪酸)、蛋白質(アミノ酸)が、分解され、消費されます。
絶食時には、蛋白質(アミノ酸)が分解され、消費されますが、糖質(ブドウ糖、果糖など)を投与すると、蛋白質(アミノ酸)の分解が抑制される(糖の蛋白節約作用)。
絶食後に、グルコース(ブドウ糖)や、フルクトース(果糖)を投与すると、速やかに、解糖系を経て、TCA回路に移行し、蛋白が節約され、また、肝臓のグリコーゲン量が増加する。
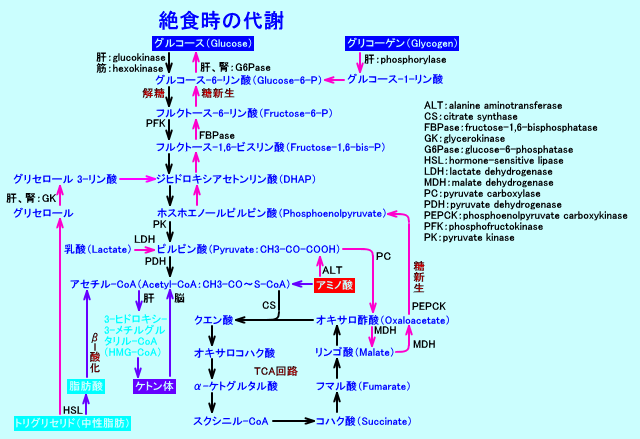
1.絶食が始まった時
a.グリコーゲンが分解され、グルコースが供給される
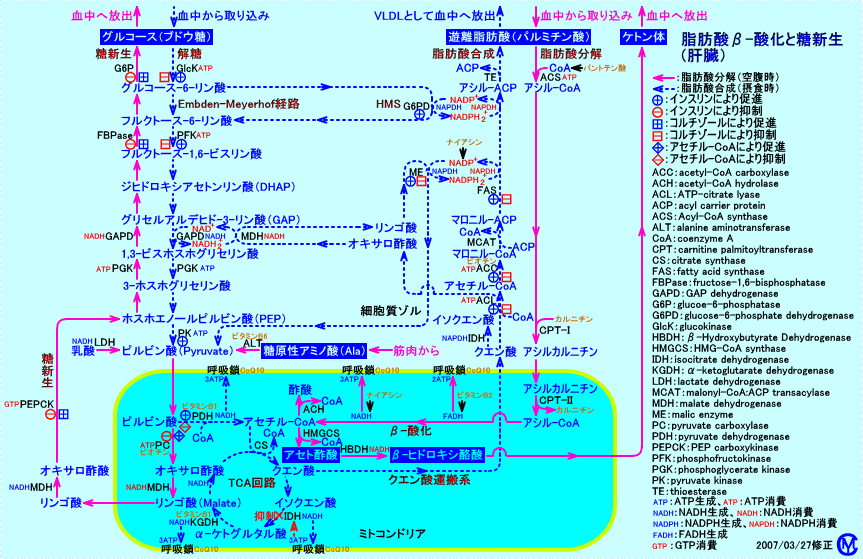
絶食により、脳の機能の維持のために不可欠なグルコース(注1)が不足すると、まず、肝臓に貯えられたグリコーゲンが、phosphorylaseにより分解されて、グルコース 1-リン酸に変換されて、グルコース-6-リン酸を経て、グルコース-6-ホスファターゼ(glucose-6-phosphatase)により、グルコースが生成されます。そして、肝臓より、グルコースが、血液中に放出されます。
フルクトース 2,6-ビスリン酸(注2)の量が多いと、解糖系に進み、少ないと、糖新生に進みます。
生体内の糖の量は約300gで、大部分は肝臓と筋肉のグリコーゲンです(注3)が、絶食により約1日で、ほとんどが消費されてしまうと言われています。筋肉のグリコーゲンは、分解されて乳酸に代謝されますが、筋肉には、グルコース 6-ホスファターゼが存在しないので、筋肉からグルコースとして放出されません。
肝臓には、グリコーゲンが貯蔵されていて、絶食時には、グリコーゲンを分解したり、糖新生をして、グルコース(ブドウ糖)を血中に供給し、低血糖に陥らないようにします。
筋肉にも、グリコーゲンが貯蔵されていますが、筋肉のグリコーゲンが分解され生成されるグルコースは、主に筋線維の活動に利用され、血糖維持には寄与しません。
なお、白血球、赤血球などでは、グルコースを解糖して乳酸とピルビン酸にまで分解し、これらは、さらに、肝臓と腎臓でグルコースに糖新生されます。
b.脂肪組織が分解されて、脂肪酸が放出される
脂肪組織のホルモン感受性リパーゼ(注4)が活性化されて、中性脂肪(トリグリセリド)が分解され、脂肪酸が、血液中を、アルブミンと結合した遊離脂肪酸として、運ばれます。
脂肪酸は、心筋、骨格筋に於いて、カルニチンと結合して、ミトコンドリア内に輸送され、β-酸化により分解されて、NADH2+やFADH2を生成しながら、アセチル-CoAとなります。アセチル-CoAは、TCA回路(クエン酸回路)に導入され、NADH2+などが生成されます。脂肪酸分解(β-酸化)や、アセチル-CoAのTCA回路での代謝により生成されるNADH2+などは、呼吸鎖で酸化され、ATPが生成されます(エネルギー源になります)。なお、脂肪酸は、心筋や、骨格筋では、β-酸化によりアセチル-CoAに分解された後、さらに、TCA回路で代謝され、二酸化炭素と水にまで、分解されますが、肝臓では、β-酸化によりアセチル-CoAに分解された後、ケトン体に生成されます。それから、脂肪酸からは、グルコースは合成できません(奇数炭素の脂肪酸は、例外)。
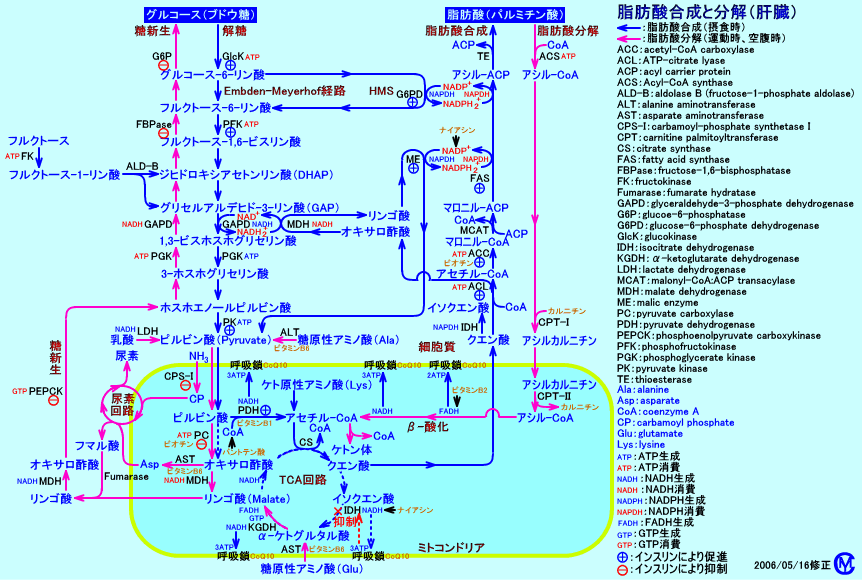
絶食時(飢餓時)には、グルコースの供給が不足するので、肝臓は遊離脂肪酸を分解(β-酸化)し、生成されるNADH2+を利用し、グルコースを生成(糖新生)します。
絶食時に糖新生が行われる際には、肝臓のミトコンドリア内では、脂肪酸分解(β-酸化)によって生成されるNADH2+濃度が上昇するので、脂肪酸分解によって生成されるアセチル-CoAは、TCA回路で酸化分解されず、ケトン体生成が盛んに行われます。
脂肪酸分解によりミトコンドリア内のアセチル-CoA濃度が上昇し(ピルビン酸カルボキシラーゼが活性化されオキサロ酢酸が生成される)、糖新生が行われると、オキサロ酢酸はホスホエノールピルビン酸(PEP)に変換されるので、肝臓では、アセチル-CoAがクエン酸となってTCA回路で酸化分解される方向には、代謝は進まなくなります。
中性脂肪の分解に伴い生成される、グリセロール(グリセリン)は、肝臓で、グルコースに糖新生されます。

c.糖原性アミノ酸が分解されて、肝臓でグルコースに糖新生される
さらに、絶食が続くと、アラニン(Alanin:Ala)などの糖原性アミノ酸(注5)が筋肉から、血液中に放出されます。
これらのアミノ酸は、肝臓で糖新生され、グルコースに変換されます。
肝臓で、糖新生で変換されたグルコースは、血液中に供給されます。
糖新生の経路は、図に↑で示しました(注6)。
筋肉量が相対的に少ない小児では、絶食中に血液中のアラニン濃度が低下して、糖新生が十分に行なえず、低血糖を来たすことがあります(注7)。
2.絶食が続いた飢餓状態の時
a.脂肪酸からケトン体が産生され、脳などでエネルギー源になる
飢餓状態では、脂肪組織で、ホルモン感受性リパーゼが活性化され、脂肪分解が亢進し、血液中に遊離された脂肪酸は、肝臓に運ばれます。
肝臓では、 脂肪酸のβ-酸化(で生成されるアセチル-CoA)の最終産物は、アセト酢酸です(心筋や、骨格筋では、脂肪酸のβ-酸化で生成されるアセチル-CoAは、二酸化炭素と水にまで、分解されます)。アセト酢酸や、アセト酢酸から生成される、3-ヒドロキシ酪酸や、アセトンは、ケトン体(注8)と呼ばれ、血液中に放出されます。
ケトン体が生成される経路は、図に↑で示しました。
ケトン体は、脳でグルコースに変わる代替エネルギー源として用いられます。ケトン体は、脳以外に、心筋、骨格筋、腎でも、アセチル-CoAに変換(転換)されて、TCA回路で利用されます。肝細胞は、ケトン体を生成するだけで、ケトン体を利用できない。
ロイシン(Leu)などのケト原性アミノ酸(注9)からも、ケトン体のアセト酢酸が生成され、アセトアセチル-CoAを経て、アセチル-CoAに変換され、利用されますが、量的にはわずかとされます。
b.糖原性アミノ酸の筋肉などからの放出が抑制され、尿中窒素排泄量が減少する
飢餓状態では、ケトン体が、グルコースに変わる代替エネルギーとして用いられるので、糖新生に消費される糖原性アミノ酸が、少なくて済みます。
飢餓状態では、糖原性アミノ酸の筋肉からの放出が抑制され、尿中窒素排泄量が、1日3gぐらいまでに減少します(注10)。
なお、 飢餓状態でも続く、皮膚、爪、髪の成長のために、アミノ酸が使用されます。
このように、長期間の飢餓状態の時には、エネルギー源として、脳はケトン体を使用し、筋肉は脂肪酸を優先的に使用し,グルコースの消費量が節約されます。
糖尿病でインスリンの作用が不足すると、血液中のグルコース濃度(血糖値)は高くなりますが、細胞内のグルコースは不足し、飢餓状態と同じ代謝状態となり、エネルギー源として、筋肉は脂肪酸を優先的に使用します。
注1:脳は、安静時に、1時間当たり約3(〜4)gのグルコース(ブドウ糖)を消費するとされています。脳は、1日当り約120g(大さじ14杯分)のグルコース(ブドウ糖)を消費すると言われます。
また、健常成人で、脳血流量55ml/100g/min、脳酸素消費量3.3ml/100g/min、脳ブドウ糖消費量5.1mg/100g/minと言うデータもあり、1,300gの脳の持ち主だと、1時間当たり約4gのグルコースを消費することになります。
なお、大脳は、1日に10kgのATP(体全体で合成されるATP量の約20%)を使用しますが、大脳中には、約1gのATPしか存在しないので、1日に1万回、分解と再合成が繰り返されていることになります(8.64秒で分解・再合成されことになります)。
注2:フルクトース-1,6-ビスリン酸ではなく、フルクトース-2,6-ビスリン酸。
フルクトース-2,6-ビスリン酸は、ホスホフルクトキナーゼの活性を賦活化させ、肝臓での解糖を促進させる。また、フルクトース-2,6-ビスリン酸は、AMP同様に、fructose-1,6-bisphosphatase(fructose-1,6-diphosphatase)の活性を抑制し、糖新生を抑制します。
グルカゴン(glucagon)は、フルクトース-2,6-ビスリン酸濃度を低下させ、糖新生を促進させます。
注3:正常成人(70kg)で、肝臓グリコーゲン量108g、筋肉グリコーゲン量245g、細胞外糖質量10gというデータがあります。血液中への、グルコース(ブドウ糖)の供給源となるのは、肝臓グリコーゲンです。
注4:
ホルモン感受性リパーゼ(HSL:hormon-sensitive lipase)は、脂肪組織の脂肪細胞内に存在し、脂肪細胞内の中性脂肪(トリアシルグリセロール)を、脂肪酸とグリセロールに加水分解します。グリセロール 3-リン酸(α-グリセロリン酸)が豊富に存在する時には、生じた脂肪酸に相当する分量は、グリセロール-3-リン酸と、再エステル化され、中性脂肪(トリアシルグリセロール)に戻ります。グリセロール-3-リン酸が不足している時には、生じた脂肪酸は、遊離脂肪酸として、血中に放出されます。グリセロール-3-リン酸の前駆体は、グルコースなので、グルコースの吸収速度が、遊離脂肪酸の動員に、関連します。ホルモン感受性リパーゼ(HSL)は、脂肪組織以外に、筋肉(骨格筋、心筋)にも、L型ホルモン感受性リパーゼ(L-HSL)が存在します。
ホルモン感受性リパーゼの活性は、cAMP濃度に依存します:cAMP濃度が上昇すると、cAMP依存性プロテインキナーゼA(PKA)が活性化され、ホルモン感受性リパーゼを活性させます。
ホルモン感受性リパーゼを活性化させるホルモンとしては、エピネフリン、ノルエピネフリン、ACTH、TSH、MSH、グルカゴン、セロトニン、甲状腺ホルモン、成長ホルモン、副腎皮質ホルモンなどがあります。成長ホルモンは、脂肪組織のリポ蛋白リパーゼ(LPL)の活性をは、抑制(低下)させます。
逆に、インスリン、PGE1、アデノシンは、ホルモン感受性リパーゼの作用を抑制する方向に作用します。なお、インスリンは、脂肪組織のリポ蛋白リパーゼ(LPL)の活性をは、上昇させます。
HSLは、筋肉(骨格筋細胞内や心筋細胞内)にも存在する。HSLは、筋肉の筋線維間(遅筋線維の間)に存在するトリグリセリドを、運動時などに、分解し、生成される遊離脂肪酸は、エネルギー源として利用されます。
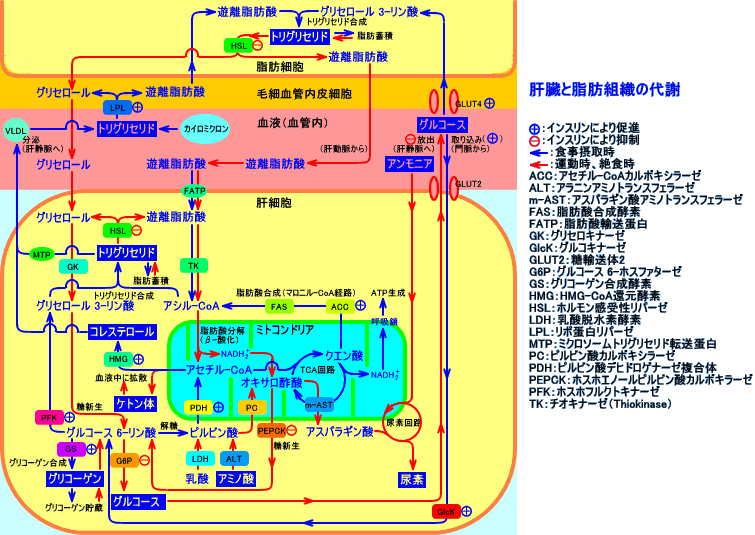
注5:糖新生に利用されるアミノ酸は、糖原性アミノ酸(glucogenic amino acid)と呼ばれます。
図には、 ピルビン酸を経てオキサロ酢酸になるアミノ酸(Ala、Gly、Ser、Thr、Cys、Trp)を示しました。
その他に、 オキサロ酢酸になりTCA回路に入るアミノ酸(Asp、Asn)、α-ケトグルタル酸になりTCA回路に入るアミノ酸(Arg、Glu、Gln、His、Pro)、スクシニル-CoAになりTCA回路に入るアミノ酸(Ile、Met、Val)、フマル酸になりTCA回路に入るアミノ酸(Phe、Tyr)があります。なお、Ala(アラニン)が、ピルビン酸になる反応では、ALT(アラニンアミノトランスフェラーゼ、別名、GPT)と言う酵素により、アミノ基が転移されます。また、Asp(アスパラギン酸)が、オキサロ酢酸になる反応、Glu(グルタミン酸)が、α-ケトグルタル酸(2-オキソグルタル酸)になる反応では、AST(アスパラギン酸アミノトランスフェラーゼ、別名、GOT)と言う酵素により、アミノ基が転移されます。
飢餓時の糖新生の50%は、アミノ酸に由来すると言われています:特に、Ala(アラニン)が、重要です。肝臓に良いと言われて来たしじみ(シジミ貝)は、アラニンを豊富に含んでいます。しじみ(シジミ貝)は、胆汁分泌作用があり、黄疸に良いと言われます。
表1 食品中のBCAA含量(可食部100g当たりの含量:五訂食品成分表2005より引用)
| 食品名 |
蛋白質 |
分岐鎖アミノ酸(BCAA) |
芳香族アミノ酸(AAA) |
BCAA/
AAA比 |
その他 |
| Val |
Leu |
Ile |
合計 |
Phe |
Tyr |
Trp |
合計 |
mg比 |
Fischer比 |
Ala |
Glu |
Met |
| g |
mg |
mg |
mg |
mg |
mg |
mg |
mg |
mg |
ratio |
ratio |
mg |
mg |
mg |
| 糸引納豆 |
16.5 |
830 |
1300 |
760 |
2890 |
870 |
680 |
240 |
1790 |
1.615 |
2.528 |
680 |
3200 |
260 |
| 木綿豆腐 |
6.8 |
380 |
600 |
370 |
1350 |
390 |
290 |
100 |
780 |
1.731 |
2.686 |
320 |
1300 |
100 |
| 凍り豆腐 |
50.2 |
2900 |
4600 |
2800 |
10300 |
3000 |
2200 |
760 |
5960 |
1.728 |
2.679 |
2400 |
9700 |
790 |
| 精白米 |
6.8 |
430 |
570 |
290 |
1290 |
370 |
280 |
99 |
749 |
1.722 |
2.702 |
390 |
1300 |
170 |
| 食パン市販 |
8.4 |
400 |
660 |
340 |
1400 |
460 |
240 |
96 |
796 |
1759 |
2.687 |
270 |
3100 |
150 |
| うどん生 |
6.8 |
300 |
510 |
260 |
1070 |
370 |
200 |
75 |
645 |
1.659 |
2.522 |
260 |
2600 |
120 |
| ごま乾 |
19.8 |
1100 |
1500 |
840 |
3440 |
1000 |
770 |
370 |
2170* |
1.585 |
2.643 |
1000 |
4000 |
720 |
| さんま生 |
20.6 |
1100 |
1600 |
950 |
3650 |
830 |
690 |
230 |
1730* |
2.110 |
3.265 |
1200 |
2800 |
660 |
| まぐろ赤身生 |
28.3 |
1400 |
2100 |
1300 |
4800 |
1000 |
920 |
320 |
2220* |
2.162 |
3.403 |
1500 |
3700 |
810 |
| 豚ひき肉 |
18.2 |
870 |
1300 |
770 |
2940 |
650 |
500 |
200 |
1400* |
2.100 |
3.467 |
1100 |
2500 |
440 |
| 若鶏むね皮なし |
22.9 |
1200 |
1900 |
1200 |
4300 |
960 |
820 |
280 |
2080* |
2.067 |
3.278 |
1400 |
3700 |
660 |
| 若鶏もも皮なし |
18.0 |
920 |
1500 |
880 |
3300 |
740 |
620 |
210 |
1610* |
2.050 |
3.291. |
1100 |
2900 |
530 |
| 鶏卵全卵生 |
12.3 |
830 |
1100 |
680 |
2610 |
640 |
500 |
190 |
1290* |
2.023 |
3.114 |
700 |
1600 |
400 |
| 牛乳生乳 |
2.9 |
190 |
280 |
150 |
620 |
140 |
110 |
38 |
288 |
2.153 |
3.369 |
93 |
560 |
75 |
| プロセスチーズ |
22.7 |
1600 |
2300 |
1200 |
5100 |
1200 |
1300 |
290 |
2790 |
2.153 |
2.794 |
670 |
5000 |
580 |
| たらこ生 |
24.9 |
1600 |
2500 |
1500 |
5600 |
1000 |
1100 |
300 |
2400 |
2.333 |
3.642 |
1900 |
3200 |
560 |
| しじみ生 |
6.8 |
360 |
460 |
300 |
1120 |
280 |
220 |
90 |
590 |
1.898 |
3.048 |
540 |
830 |
180 |
| ほうれんそう生 |
3.3 |
120 |
170 |
95 |
385 |
120 |
88 |
53 |
263* |
1.464 |
2.512 |
110 |
300 |
29 |
*:芳香族アミノ酸(AAA)の項の合計量で、*印を上付きに表示した食品は、五訂食品成分表2005で、芳香族アミノ酸(AAA)の合計量が、フェニルアラニン(Phe)と、チロシン(Tyr)の数値を足した値と異なっています。
1日、最低50gのグルコースを投与すると、糖新生のために、蛋白が分解(異化)されることが、抑制されると言われています(体蛋白異化抑制効果:protein
sparing effect)。
注6:糖新生の経路は、解糖の逆経路ではありません。
注7:筋肉量が相対的に少ない小児では、絶食中に血液中のアラニン濃度が低下して、糖新生が十分に行なえず、低血糖を来たすことがあり、ケトン性低血糖症と呼ばれています。
また、小児では、周期性嘔吐症(自家中毒、アセトン血性嘔吐症)と呼ばれる、感冒などで発熱した際に、腹痛や嘔吐をくり返す病気があります。周期性嘔吐症では、血中や尿中ケトン体は、上昇しますが、一般に、低血糖は、認められません。しかし、周期性嘔吐症も、ケトン性低血糖症と同様に、糖新生が、不十分で、生じる病気と、考えられます。
それから、脂肪酸のβ酸化に異常がある脂肪酸酸化異常症(FAOD)では、脂肪酸は、ミトコンドリアに入ってβ-酸化でアセチル-CoAに分解されません。その為、TCA回路で、糖新生に必要なNADH2+が生成されないので、低血糖になります。また、アセチル-CoAが少ないので、ケトン体が、生成されにくい為、FAODの乳児は、低血糖があるのに、尿中ケトン体の濃度は、低いことが、検査所見で特徴で、低ケトン性低血糖と、呼ばれています。
なお、サリチル酸(アスピリンが、体内で代謝されて生成されます)などのNSAIDsには、ミトコンドリアの機能を障害(膜電位を低下させ、TCA回路でのNADH2+生成や、呼吸鎖でのATP生成が、低下してしまう)して、糖新生を減少させる作用のある薬剤もあります。これらの薬剤によって、糖新生が、減少すると、低血糖を来たすと、考えられます。
注8:ケトン体には、アセト酢酸、3-ヒドロキシ酪酸(β-ヒドロキシ酪酸)、アセトンがあります。
ケトン体は、エネルギー源としてのグルコース(ブドウ糖)が不足し、脂肪酸のβ-酸化が促進される(糖新生が行われる)と、肝臓で、生成されます。ケトン体は、脂肪酸がβ-酸化されて生成されるアセチル-CoAから生成されます。ケトン体は、バリン、ロイシン、イソロイシン等、分岐鎖アミノ酸(BCAA)の代謝でも生成されますが、量は少ないと言われます。
肝臓で、脂肪酸がβ-酸化され生成されたアセト酢酸は、NADH2+により還元されると3-ヒドロキシ酪酸(β-ヒドロキシ酪酸)となります。両者は、水溶性で、無毒であり、分解されるとアセチル-CoAとなる生理的燃料です。アセト酢酸は、不安定な化合物であり、時間が経過すると、脱炭酸により、アセトンになりますが、アセトンは生理的燃料にはなりません。アセトンは、揮発性であり、肺から排出されます。
肝臓で生成されたケトン体は、血中を輸送され、末梢組織(筋肉や脳)の細胞から、グルコースや脂肪酸に優先して、取り込まれ、ミトコンドリア内で、2分子のアセチル-CoAとなり、TCA回路で代謝され、即効性のエネルギー源となります。絶食時等には、脂肪酸から生成されるケトン体(アセト酢酸、β-ヒドロキシ酪酸)は、水溶性の燃料分子(代謝燃料)として、脳や、心臓や、骨格筋や、腎臓や、腸管等で、エネルギー源として利用されます。安静時には、心筋が最も多くケトン体を利用し、運動時には、骨格筋がケトン体を最も多く利用します。
血中のケトン体は、血中濃度に比例して、肝外組織で利用(酸化)されます。ケトン体は、グルコースや遊離脂肪酸(FFA)より優先的に利用されます。しかし、肝臓からのケトン体の放出が増加し、肝外組織での酸化速度を越えると(70mg/100ml相当)、ケトン体が血中に蓄積し、ケトン体の血中濃度が上昇し、尿中への排泄が増加します。
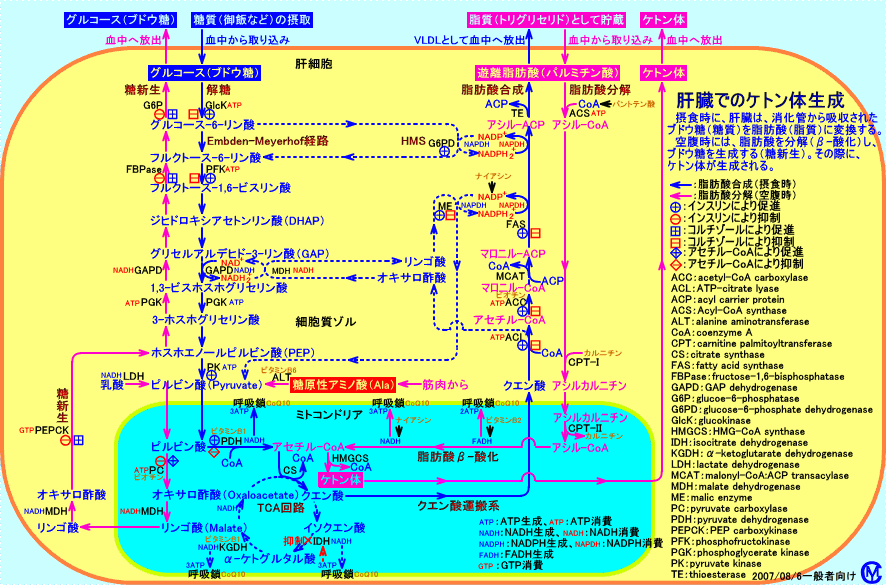
肝臓は、ケトン体を合成(産生)する酵素活性(HMG-CoAシンターゼ)は高いが、ケトン体を代謝(分解)する酵素(スクシニル-CoAトランスフェラーゼ)の活性が低いことが知られています。スクシニル-CoAトランスフェラーゼ(スクシニルCoA-3-オキソ酸CoAトランスフェラーゼ、succinyl-CoA:3-oxo-acid
CoA-transferase:SCOT、EC-Number 2.8.3.5、thiophorase)は、ケトン体のアセト酢酸をスクシニル-CoAと反応させ、アセトアセチル-CoAとコハク酸に変換させます(スクシニル-CoAはケトン体の分解に必要です)。アセトアセチル-CoAは、更に、チオラーゼにより、2分子のアセチル-CoAに分解されます。このように、スクシニル-CoAトランスフェラーゼは、ケトン体(アセト酢酸)が、アセチル-CoAに分解(開裂)されるのに必要な酵素ですが、肝臓は、このスクシニル-CoAトランスフェラーゼを有していないので、産生したケトン体をアセチル-CoAに再分解して利用出来ません。スクシニル-CoAトランスフェラーゼは、肝臓以外の全ての組織に存在します。従って、肝臓以外の組織(脳、骨格筋、心筋、腎臓、副腎、腸など)は、ケトン体をアセチル-CoAに分解して、燃料分子として利用出来ます。
HMG-CoAシンターゼは、肝細胞のミトコンドリア内にのみ存在し、他の組織の細胞には、存在しません。ヒトでは、ケトン体を産生して血液中に放出する臓器は、肝臓だけです(反芻動物は、第1胃壁で胃内発酵で生成される酪酸をβ-ヒドロキシ酪酸に変換し、ケトン体として血中に放出します)。肝臓(HMG-CoAシンターゼを有するがスクシニル-CoAトランスフェラーゼは有しない)は、ケトン体を産生を産生し、肝臓以外の組織(HMG-CoAシンターゼを有しないがスクシニル-CoAトランスフェラーゼを有する)がケトン体をアセチル-CoAに再分解して利用します。
体内にケトン体が増加する病態は、ケトーシス(ketosis)と呼ばれ、アセトン以外のケトン体は、比較的強い酸なので、アシドーシス(酸血症)を招くので、ケトアシドーシス(ketoacidosis)と呼ばれています。ケトン体の産生が増加しているような、脂肪酸のβ-酸化が亢進している際には、ミトコンドリア内の遊離CoAが欠乏し、アセチル-CoAが、加水分解され、遊離CoAと酢酸とに、分解されます。酢酸(短鎖脂肪酸)は、肝臓から血液中に放出され、他の組織で、ケトン体と同様に、代謝燃料として、利用されますが、酢酸は、ケトン体(アセト酢酸、β-ヒドロキシ酪酸)は、酸性物質なので、血液が酸性化し、ケトン体による、ケトアシドーシスを促進させると言われます。
ケトーシスは、肝臓でのケトン体の産生の増加が原因で起こることが多いですが、肝外組織でのケトン体を利用(酸化)する能力が低下しても起こります(重症の糖尿病など)。
尿ケトン体は、絶食が続いた飢餓状態の時以外には、糖尿病(インスリンが欠乏し、グルコースが利用できない)、高脂肪食、運動後などでも、認められます。
なお、血清ケトン体は、3-ヒドロキシ酪酸(β-ヒドロキシ酪酸):アセト酢酸:アセトン=1.2:1.0:0.5程度で、3-ヒドロキシ酪酸がもっとも多く含まれています。これは、3-ヒドロキシ酪酸の方が、尿細管での再吸収が良好で、アセト酢酸の尿中排泄量が相対的に多いためと考えられています。
絶食時に産生されるケトン体は、脳の満腹中枢の働きを高めますが、空腹中枢の働きを抑制しないので、空腹感が無くなります。
大量のケトン体が生成される際には、同時に、酢酸(短鎖脂肪酸)も生成されます。酢酸は、無毒な生理的燃料として、末梢細胞のエネルギー源となりますが、酸性物質なので、ケトアシドーシスを増悪させます。
重症のケトーシスが起こる場合には、血液中の遊離脂肪酸濃度も増加しています。肝臓は、通過する血液中の遊離脂肪酸の約30%を取り込むことが可能です。肝臓に取り込まれた遊離脂肪酸は、中性脂肪、リン脂質、コレステロールなどにエステル化される(摂食時など)か、分解(β-酸化)されアセチル-CoAになります:アセチル-CoAは、TCA回路で酸化されるか、ケトン体生成に利用されます(空腹時など)。
ケトーシスの程度は、肝臓内の脂肪量より、脂肪組織などの(貯蔵)脂肪量と関連があります。
(血中の)総ケトン体が、0.2mM(200μmol/L)以上だとケトーシス、7mM(7,000μmol/L)以上だとケトアシドーシスと呼ばれます。ケトン体は、摂食時(食後)には0.05mM以下に低下しますが、空腹時には幼児では6mM程度と、100倍以上に増加します。
ケトン体は、肝臓で、脂肪酸分解(β-酸化)が亢進した際(飢餓時など糖新生が盛んに行われる際など)に産生され、水溶性なので、血液中を他の組織(脳、筋肉、腎臓、副腎など)に輸送されます。
血液中のケトン体は、血液中のグルコース(ブドウ糖)や脂肪酸より、優先的に、他の組織の細胞に取り込まれ、ミトコンドリア内で2分子のアセチル-CoAに分解(開裂)し、TCA回路で酸化分解され、代謝燃料になります(アセト酢酸から自然に生成されるアセトンは、揮発性の為、肺から排出され、代謝燃料になりません)。
ケトン体が肝臓で生成される際(飢餓により糖が不足して糖新生が行われる時など)は、ミトコンドリア内では、脂肪酸分解(β-酸化)によって生成されるNADH2+濃度が上昇するので、脂肪酸分解によって生成されるアセチル-CoAは、TCA回路で酸化分解されず、ケトン体生成が行われます。
また、ミトコンドリア内のアセチル-CoA濃度が上昇し(ピルビン酸カルボキシラーゼが活性化されオキサロ酢酸が生成される)、糖新生が行われると、オキサロ酢酸はホスホエノールピルビン酸(PEP)に変換されるので、肝臓では、アセチル-CoAがクエン酸となってTCA回路で酸化分解される方向には、代謝は進まなくなります。
一般的に、尿中ケトン体濃度は、血清中ケトン体濃度より、高い傾向があります。
ケトーシス(ketosisi:体内にケトン体が増加した状態)では、アセトン以外のケトン体は比較的強酸な為、アシドーシス(血液が酸性に傾いた上体)になります(ケトアシドーシス:ketoacidosis)。
ケトーシスは、生体内に糖質(グルコース)が不足し、生体が糖質よりも脂質(遊離脂肪酸)をエネルギー源として利用している状況(飢餓、運動、高脂肪食、糖尿病、外傷、手術、発熱など)で見られます。
炭水化物(グルコース)が不足している状況(絶食時など)では、ケトン体(酢酸のような短鎖脂肪酸も含む)→遊離脂肪酸→グルコースの順に、利用(酸化)されます。
脂肪酸分解(β-酸化)が亢進し、NADH2+が過剰に生成されミトコンドリア内が還元状態になっている代謝状況(飢餓時の糖新生時など)では、アセチル-CoAは、ケトン体のアセト酢酸を経て3-ヒドロキシ酪酸に変換されます。
アセト酢酸と3-ヒドロキシ酪酸との関係は、乳酸とピルビン酸と類似していて、血液中では、3-ヒドロキシ酪酸が多く、組織(ミトコンドリア内)ではアセト酢酸に変換されて代謝されます。
インスリンは、ケトン体産生を抑制します:脂肪細胞からの遊離脂肪酸の放出を抑制(HSLを抑制)し、肝細胞のミトコンドリア内への遊離脂肪酸(アシル-CoA)の取り込みを抑制(マロニル-CoAを取り込むCPT-Iを抑制)し、肝細胞のHMG-CoA合成酵素(HMGS)を抑制し、ケトン体産生を抑制します。食後など、インスリン分泌が増加すると、ケトン体産生が抑制されます。
カテコールアミン(アドレナリンなど)やグルカゴンは、ケトン体産生を促進します:カテコールアミンは、脂肪細胞からの遊離脂肪酸の放出を促進(HSLを促進)し、グルカゴンは肝細胞のミトコンドリア内への遊離脂肪酸の取り込みや肝細胞のHMG-CoA合成酵素を促進し、ケトン体産生を促進します。飢餓(絶食)、発熱、ストレス状態(精神的、肉体的)は、グルカゴンやカテコールアミンの産生を亢進させ、ケトン体の産生が刺激されます。

ケトスティック(検尿試験紙)は、アセト酢酸を検出するが、3-ヒドロキシ酪酸をは検出しません。
血中アセト酢酸濃度が100μmol/Lを超えると、尿中アセト酢酸濃度が増加し、1,000μmol/Lを超えると、ケトスティックが陽性化すると言われます。
注9:Leu(アセト酢酸とアセチル-CoAを生成)、Lys(アセトアセチル-CoAを経て、アセチル-CoAを生成)は、ケト原性アミノ酸(ketogenic amino acid)です。
Ile(チオール分解の段階で、アセチル-CoAを生成)、Trp(アセトアセチル-CoAを経て、アセチル-CoAを生成)、Phe、Tyr(アセト酢酸を経て、アセトアセチル-CoAを生成)は、ケト原性アミノ酸かつ糖原性アミノ酸です。
注10: 24時間の絶食時(基礎代謝1,800Kcalの場合)は、筋肉蛋白(アミノ酸)75g、脂肪組織(中性脂肪)160gが分解され、グルコース180g、脂肪酸120g、ケトン体60gが作られると言われます:中性脂肪160gから、グリセロール16gと脂肪酸160gとが、生成されます。グリセロール16gは、肝臓で、糖原性アミノ酸と同様、糖新生に、利用されます。脂肪酸160gの内、脂肪酸40gから、ケトン体60gが生成され、残りの脂肪酸120gは、心筋、骨格筋、腎臓などのエネルギー源になります。
5〜6週間の飢餓状態時(基礎代謝1,500Kcalの場合)は、筋肉蛋白20g、脂肪組織150gが分解され、グルコース80g、脂肪酸150g、ケトン体57g、グリセロール15gが作られると言われています。
基礎代謝の基礎エネルギー消費量(basal energy expenditure:BEE)は、下記のハリス・ベネディクトの式(Harris-Benedict)により求められます。
・男性:66.47+(13.75×体重)+(5.0×身長)−(6.76×年齢)
・女性:655.10+(9.56×体重)+(1.85×身長)−(4.68×年齢)
参考文献
・ハーパー・生化学(丸善株式会社発行、1975年).
・ヴォート生化学(東京化学同人、2003年、第4刷).
・鈴木紘一、他:ホートン生化学 第3版(東京化学同人、2005年、第3刷).
・菊池方利:肝における糖調節機構について 日本醫事新報 No.4184(2004年7月3日)、21-30頁.
・田川邦夫:からだの働きからみる代謝の栄養学 タカラバイオ株式会社(2003年).
・川嶋昭司、他:食べもののメリット・デメリット事典 農文協(1988年).
・香川芳子:五訂食品成分表2005(女子栄養大学出版部、2005年).
・河合忠:目で見る初期診療の検査計画と結果の読み方(エスアールエル、1997年).
・東口高志:ナーシングQ&A 全科に必要な栄養管理Q&A、総合医学社(2005年).
・深尾敏幸:総説 ケトン体代謝異常症:特にアセトン血性嘔吐症と鑑別すべきサクシニル-CoA : 3-ケト酸CoAトランスフェラーゼ(SCOT)欠損症を中心に、日本小児科学会雑誌、111巻6号、727-739頁、2007年.
|トップページ|脂質と血栓の関係|ミニ医学知識|生化学の知識|医学の話題|小児科疾患|生命の不思議|リンク集|


