



アセトン血性嘔吐症
【ポイント】
アセトン血性嘔吐症では、顔色不良になり、頻回の嘔吐が現れる。嘔吐に伴ない、コーヒー残渣様の吐物が見られることもある。低血糖を伴なうこともある。アセトン血性嘔吐症は、2〜6歳の子供が、発症する(乳児には見られない)。
口臭が、アセトン臭(やや酸っぱい様な臭い)になる。
尿検査で、尿中ケトン体が、強陽性を示す。腹部の皮膚は、緊張が低下し、柔らかく触れる。
治療は、ブドウ糖を含む甘い物を食べさせたり、ブドウ糖を含む飲料(スポーツドリンク等)を飲ませる。嘔吐して、経口摂取出来ない場合には、20%ブドウ糖液を静脈注射する(20%ブドウ糖液
20ml+ビタミンB1 10mg)。
夕食を食べずに寝ると、空腹時間が長くなり、翌朝に、アセトン血性嘔吐症の発作を起こすことが多い。
アセトン血性嘔吐症(自家中毒)になる小児は、ケトン体(飢餓時などに肝臓で生成される)の肝外組織(脳など)での利用が不良で、血中にケトン体が蓄積し、アシドーシスを起こし易いと考えられる。
アセトン血性嘔吐症(自家中毒)の発作予防には、普段から、御飯など糖質(炭水化物)中心の食事を摂り、脂肪摂取を控えることが良いと考えられる。また、肝外組織のケトン体の代謝能力が低下しないように、普段から、ビタミン類(ビタミンB1等)を十分に摂取することも、発作予防の為、大切と考えられる。
1.症状
アセトン血性嘔吐症の小児は、嘔吐(1日数回〜十数回)して、腹痛、食欲不振等を訴え、顔色不良(顔面蒼白)になり、元気がなくなる。
口臭が、アセトン臭(やや酸っぱい様な臭い)になる。
アセトン血性嘔吐症は、2〜6歳の子供が発症する。
アセトン血性嘔吐症は、周期性嘔吐症、自家中毒症(注1)等とも、呼ばれる。
アセトン血性嘔吐症では、嘔吐(1日数回〜十数回)、嘔気、食欲不振、腹痛等の症状が見られる。
アセトン血性嘔吐症では、顔色不良で、ぐったりし、口臭が、アセトン臭(アセトン様口臭:やや酸っぱい、林檎が腐った時の様な臭い)になる。検尿では、尿中ケトン体が、強陽性になる(尿試験紙のケトン体を検出する部分が、強く、紫色になる)。低血糖(多くは、血糖値は、40mg/dl代にまで低下する)が見られることがある(ケトン性低血糖症)。種々の程度の意識障害も見られる。時に、痙攣発作を引き起こす。
アセトン血性嘔吐症では、四肢冷感、頻脈、腹壁緊張低下等が見られる。
アセトン血性嘔吐症では、急性胃腸炎と異なり、嘔吐はしても、下痢は、伴なわないことが多い。
アセトン血性嘔吐症は、小児が、消化器疾患や上気道炎に罹患したり、疲労や精神的ストレス(緊張)が加わったり、食事を摂取しなかった後等に、起こることが多いが、明らかな原因がなく、嘔吐等の症状が起こることもある。
アセトン血性嘔吐症の発作は、早朝に発症が見られることが多い。発症前の日の夕方、いつもより早く、夕食を食べずに寝ると、空腹時間が長くなり、翌朝に、アセトン血性嘔吐症の発作を起こす。
アセトン血性嘔吐症は、2〜6歳の子供(男児に多い)に、見られる:アセトン血性嘔吐症は、初発するのは、18カ月以降の小児。アセトン血性嘔吐症は、9〜10歳を過ぎると、起こらなくなる。アセトン血性嘔吐症は、普通、乳児や思春期以降の小児には、見られない。乳児、1歳代の小児が、アセトン血性嘔吐症(自家中毒症)様の症状を示す場合は、他の疾患である可能性が高い。
アセトン血性嘔吐症は、スリムな痩せ形の体格の子供(筋肉質でない、華奢な体格の男子)に多いと言われる。
アセトン血性嘔吐症の発作の回数に関しては、2〜3カ月に1回程度の頻度で発作を起こす小児もいれば、1年に1回程度の頻度で発作を起こす小児もいる。
アセトン血性嘔吐症の嘔吐は、最初は、食物残渣を嘔吐するが、次第に、水様粘稠な液(粘液の混じった胃液)を嘔吐するようになる。さらに、アセトン血性嘔吐症の嘔吐は、回数が多いと、コーヒー残渣様になる(注2)。通常、嘔吐は、2〜3日間続くが、重症例では、嘔吐が、4〜5日間続く。
2.所見・検査
アセトン血性嘔吐症の小児は、顔色不良(顔面蒼白:低血糖が原因)で元気なく、口からアセトン臭(やや酸っぱい様な臭い)がする。
検尿では、尿中ケトン体が、強陽性を示す(尿試験紙のケトン体を検出する部分が、強く、紫色になる)。尿中ケトン体(尿中一般物質定性半定量検査 尿中ケトン体)は、普通の試験紙法(ニトロプルシド法)は、主に、アセト酢酸を検出する(感度5mg/dl以上)。
血糖値も、40mg/dl代に低下することがある(ケトン性低血糖症)。ケトン体が肝臓で生成されるのは、糖(グルコース)が不足し、脂肪酸分解(β-酸化)が盛んに行われ、糖新生が進行しているような代謝状態であり、脂肪酸分解(β-酸化)によりアシルCoAやアセチルCoAが生成され、ミトコンドリア内などのCoAが不足する為、アセチルCoAからアセト酢酸が生成される(アセチルCoAがTCA回路で分解されない)。
アセトン血性嘔吐症では、腹部の皮膚は、緊張が低下し、柔らかく触れる。嘔吐が続いていると、腹部は、陥没している。
アセトン血性嘔吐症は、上気道炎等の感染症を契機に発症した場合には、発熱が見られるが、アセトン血性嘔吐症典型的には、無熱な場合が多い。
アセトン血性嘔吐症では、脈拍は、頻脈になるが、緊張は良い。股動脈音が、聴取される。
四肢末端に冷感が現れることがあるが、口唇のチアノーゼは、現れない。
アセトン血性嘔吐症では、便通は、便秘に傾くことが多い。急性胃腸炎を契機に発症した場合には、下痢を伴なうこともある。テール便(血便)を出すこともある。
アセトン血性嘔吐症では、血中の乳酸値が、上昇する(乳酸からの糖新生が減退している)。
アセトン血性嘔吐症では、ピルビン酸値も上昇する。
表1 アセトン血性嘔吐症の検査値(参考文献の表3の香坂氏のデータを引用)
| 検査項目 |
単位 |
平常時 |
アセトン血性嘔吐症 |
| グルコース |
mg/dl |
85.2±22.6 |
77.4±23.8 |
| 乳酸 |
mg/dl |
12.9±6.3 |
22.5±5.4 |
| ピルビン酸 |
mg/dl |
0.69±0.43 |
0.79±0.31 |
| 乳酸/ピルビン酸比 |
ratio |
18.6±5.2 |
28.5±9.2 |
| 血清β-ヒドロキシ酪酸 |
mM/L |
0.162±0.125 |
1.83±1.440 |
| 血清アセト酢酸 |
mM/L |
0.088±0.051 |
0.383±0.285 |
| 血清β-ヒドロキシ酪酸/アセト酢酸比 |
ratio |
1.84±0.95 |
4.72±2.80 |
| 尿中β-ヒドロキシ酪酸 |
mM/L |
0.091±0.081 |
33.15±34.0 |
| 尿中アセト酢酸 |
mM/L |
0.068±0.041 |
8.25±4.8 |
| 尿中β-ヒドロキシ酪酸/アセト酢酸比 |
ratio |
1.34±0.75 |
4.02±3.31 |
3.発症機序
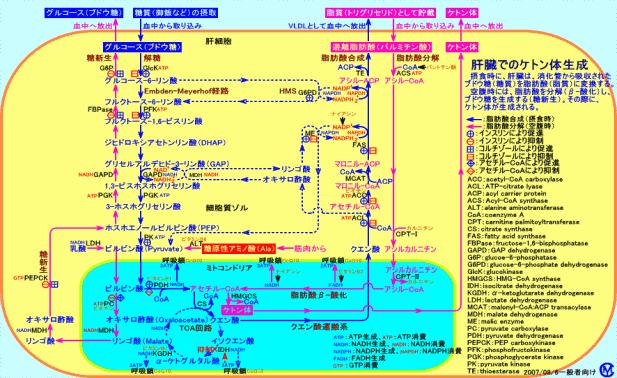
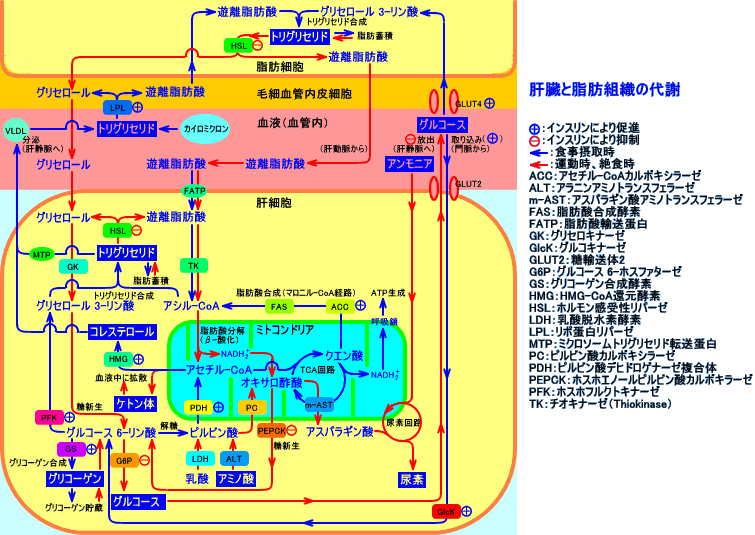
人間の脳は、グルコース(ブドウ糖)を、エネルギー源にしているので、生体は、主に、肝臓に於いて、糖新生や貯蔵グリコーゲン分解を行って、血液中にグルコース(ブドウ糖)を供給し、血糖値が低下しないように維持している(血糖維持機構)。
飢餓(空腹)時や、ストレス(上気道炎等)時等、グルコースの必要量が高まると、肝臓では、脂肪酸をβ-酸化し、エネルギー(NADH2+等)を生成し、糖新生を行って、血液中にグルコースを供給する(注3)。
肝臓での脂肪酸のβ-酸化が亢進すると、β-酸化によって生成された余剰なアセチル-CoAは、ケトン体(アセト酢酸、β-ヒドロキシ酪酸)に変換される(注4)。肝臓は、ケトン体を生成するが、ケトン体(アセト酢酸)をエネルギー源として利用出来ない。肝臓には、ケトン体をアセチル-CoAに分解する過程で必要な酵素(スクシニル-CoAトランスフェラーゼ)が存在しない(注5)。ケトン体は、筋肉(心筋、骨格筋)、脳、腎臓、副腎等で、エネルギー源として利用されるが、ケトン体の血中濃度が上昇し過ぎる(アセトン血症)と、尿中から排泄される(ケトン尿)。絶食時等には、脂肪酸から生成されるケトン体(アセト酢酸、β-ヒドロキシ酪酸)は、水溶性の燃料分子(代謝燃料)として、脳や、心臓や、腎臓で、エネルギー源として利用される。
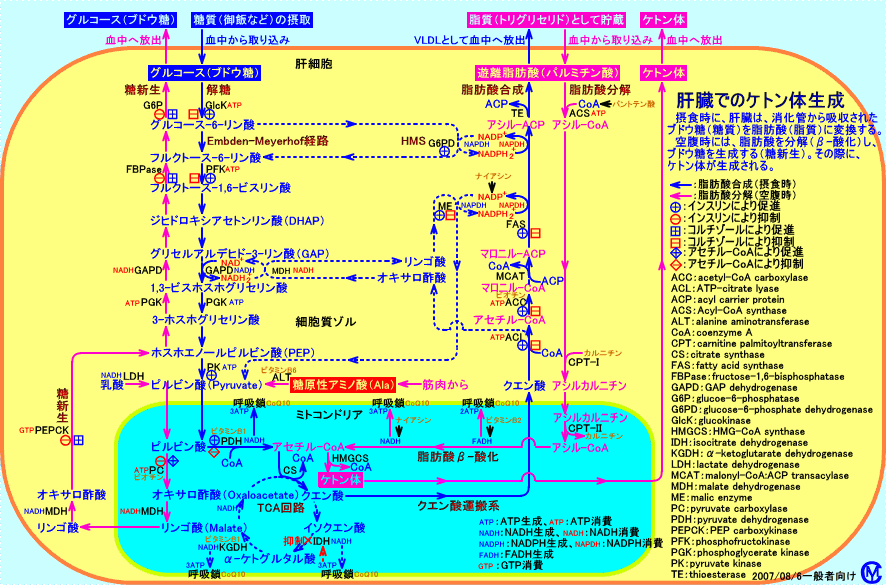
肝臓での脂肪酸のβ-酸化が亢進し(ケトン体の産性が増加し、アセトン血症になる)、糖新生が行われても、必要な量のグルコースが生成されないと、低血糖になる(ケトン性低血糖症)。
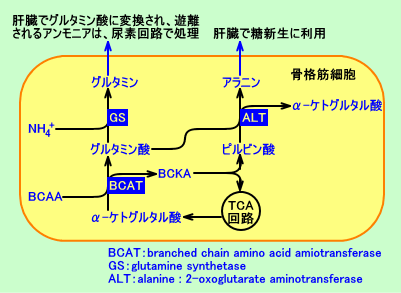
糖新生には、糖原性アミノ酸(アラニン等)の炭素骨格や、ピルビン酸からがピルビン酸カルボキシラーゼ(PC)により生成されるオキサロ酢酸の炭素骨格が、用いられる。従って、筋肉量が少ない小児(2〜6歳の痩せた体型の小児)は、糖新生が十分に行われず、アセトン血性嘔吐症を、起こし易い。また、ビタミン類(ビタミンB1、ビタミンB6、ビオチン等)の不足も、糖新生が十分に行われず、アセトン血性嘔吐症を、起こす原因となると考えられる(注6)。
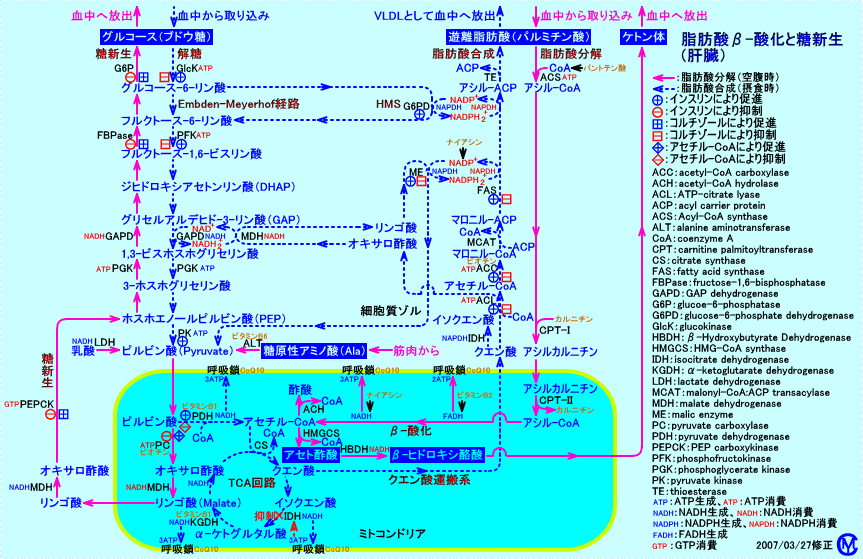
正常児でも、幼児や、学童や成人に比して、短時間の飢餓(空腹)や、ケトン食負荷により、アセトン血症(ケトン血症)を来たし易い(体重に比して、体表面積が広い幼児は、熱の発散量が多く、基礎代謝が高い)。
小児は、飢餓(空腹状態)が続くと、アセトン血症を来たし易いので、小児は、感染症等に際して、検尿をすると、アセトン血性嘔吐症でなくても、尿中ケトン体が陽性になる。典型的なアセトン血性嘔吐症では、尿中ケトン体は、強陽性を示す。
アセトン血性嘔吐症では、血中にケトン体が増加し、ケトアシドーシス(代謝性アシドーシス)になる。
アセトン血性嘔吐症では、頻回に嘔吐していても、アルカローシスにならない。
体内にケトン体が増加する病態は、ケトーシス(ketosis)と呼ばれ、アセトン以外のケトン体は、比較的強い酸なので、アシドーシス(酸血症)を招くので、ケトアシドーシス(ketoacidosis)と呼ばれている。
大量にケトン体が、産生されるような際には、同時に、酢酸も産生される。ケトン体の産生が増加しているような、脂肪酸のβ-酸化が亢進している際には、ミトコンドリア内の遊離CoAが欠乏し、アセチル-CoAヒドロラーゼ(acetyl-CoA hydrolase)により、アセチル-CoAが、加水分解され、遊離CoAと酢酸とに、分解される。酢酸(短鎖脂肪酸)は、肝臓から血液中に放出され、他の組織で、ケトン体と同様に、代謝燃料として、利用されますが、酢酸は、ケトン体(アセト酢酸、β-ヒドロキシ酪酸)は、酸性物質なので、血液が酸性化し、ケトン体による、ケトアシドーシスを促進させると言われる。
アセトン血性嘔吐症と鑑別を要する疾患には、脳腫瘍、癲癇の自律神経発作、周期性ACTH・ADH分泌過剰症、心因性嘔吐、消化器疾患(腸回転異常、腸軸捻転、総胆管拡張症)等がある。また、先天性代謝異常症である、中鎖脂肪酸(MCT)代謝異常症等の脂肪酸酸化異常症(FAOD)、尿素回路代謝異常症(CPT-I欠損症等)、イソ吉草酸血症等も、アセトン血性嘔吐症と鑑別を要する。
なお、脂肪酸酸化異常症(FAOD)では、脂肪酸のβ-酸化が障害され、糖新生が行われないので、ストレス時等に、低血糖発作を来たす。しかし、脂肪酸酸化異常症(FAOD)の場合は、アセトン血性嘔吐症やケトン性低血糖症)と異なり、低血糖があるのに、尿中ケトン体の濃度は、低い(低ケトン性低血糖症)。
4.治療
嘔気や嘔吐がひどくない場合には、経口的に、糖分(ブドウ糖)を含む飲料(スポーツドリンク、炭酸を含まないジュース等)を、30分から1時間毎に、飲ませる。
砂糖、飴等も、良い。番茶に砂糖を加えて飲ませる(砂糖の濃度は、5%程度にする。砂糖の濃度が濃すぎると、番茶の浸透圧が高くなり、胃が刺激され、嘔吐を誘発してしまう)。
頻回の嘔吐が見られ、経口摂取出来ないような場合には、20%ブドウ糖液を20〜40ml、静脈注射(one shot)する(注7)。
20%ブドウ糖液は、幼児20〜40ml、学童40〜60mlを、ビタミンB1、ビタミンB2、ビタミンC等を添加して、静脈注射する。
頻回の嘔吐が見られ、排尿も見られない場合(脱水の程度が強い場合)には、ソリタT1号(100〜200ml)の初期輸液を行い、排尿が見られたら、ソリタT3号の維持輸液を行う(入院加療)。
1病日以上経過して、嘔吐等が収まらないで受診した場合には、ソリタT1号200mlに、20%ブドウ糖液を40ml、ビタミンB1を10mg、ビタミンB2を2mg(フラビタン5mg)、ビタミンCを100mg添加し、点滴静注する(ソリタT1号は、10ml/kg/時の速度で点滴静注する)。
アセトン血性嘔吐症の治療や、予防としては、チョコレートや高脂肪食の摂取を控える。
アセトン血性嘔吐症の予防としては、疲労していても、夕食等を摂取しないで、空腹のまま寝かせつけないようにすることが重要(空腹時間が、長くならないようにする)。蛋白や炭水化物を、十分に摂取する。ビタミン類(ビタミンB1、ビタミンB6、ビオチン等)は、普段から、不足しないように、十分に摂取する。
アセトン血性嘔吐症には、副腎皮質ステロイドホルモン(ステロイド剤)やACTHが、著明な治療効果を示す。ステロイド剤は、(ソリタT1号を点滴静注中に三方活栓から、)ハイドロコーチゾン20mgを静注する。
ステロイド剤(コルチゾール等)は、糖新生を促進させるので、血糖値が上昇する。
アセトン血性嘔吐症の発作時には、血中コルチゾールは、上昇している。インスリンは、血糖値に比して、低値を示す(インスリンは、糖新生を抑制するホルモン)。
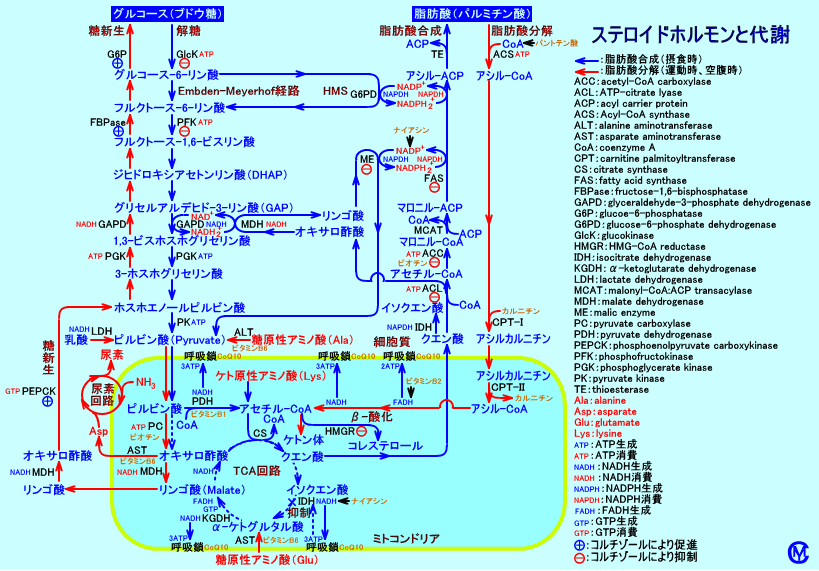
5.ケトン性低血糖症
アセトン血性嘔吐症に低血糖が見られる場合は、ケトン性低血糖症(ketogenic
hypoglycemia)、ケトン血性低血糖症、または、アセトン血性低血糖症と呼ばれる。
ケトン性低血糖症(ケトン血性低血糖症)は、糖原性アミノ酸(アラニン等)の予備能が少ないこと、肝臓グリコーゲン量が減少していること等が、原因で、飢餓時等に、血糖維持機構(肝臓での糖新生等)が、十分に機能せず、ケトン体の増加(脂肪酸のβ-酸化の亢進)を伴なう低血糖を来たすと、考えられている。
ケトン性低血糖症(ketogenic hypoglycemia)の小児(18mo〜5yr)は、一晩の空腹(overnaighit
fast)後の血漿アラニン濃度が、著明に低い。ケトン性低血糖症の小児に、アラニン(250mg/kg)を静脈注射すると、血糖が、急速に回復(上昇)する。
ケトン性低血糖症の小児では、(骨格筋由来の)アラニン(糖新生の基質)が、減少(欠乏)している。ケトン性低血糖症の小児では、フルクトース(果糖)や、グリセロールからの糖新生能や、グリコーゲン分解能は、異常がない。
ケトン性低血糖症の予防には、高蛋白質で高炭水化物の食事(a high-protein, high-carbohydrate diet)を、頻回に食べさせるのが良い(高脂肪食は良くない)。
ケトン性低血糖症の小児は、同年代の小児より華奢な(small)なことが多い。ケトン性低血糖症は、筋肉量(musle
bulk)が増加する8〜9歳には、自然に起こらなくなる。
ケトン性低血糖症の小児は、5歳以下の小児に多い(男子が多い)が、学童期(9歳〜10歳未満)にも、低血糖が見られる。
アセトン血性嘔吐症(自家中毒症)は、嘔吐が主な症状で、ケトン性低血糖症は、低血糖による症状(顔面蒼白、意識障害等)が主な症状になる。
6.SCOT欠損症
SCOT(スクシニルCoA-3-オキソ酸CoAトランスフェラーゼ、サクシニル-CoA : 3-オキソ酸CoA転移酵素、サクシニル-CoA
: 3-ケト酸CoAトランスフェラーゼ、succinyl-CoA:3-oxo-acid CoA-transferase、EC-Number 2.8.3.5、スクシニル-CoAトランスフェラーゼ、thiophorase、Succinyl-CoA:3-ketoacid-CoA transferase)は、ケトン体のアセト酢酸をスクシニル-CoAと反応させ、アセトアセチル-CoAとコハク酸に変換させる酵素。
SCOTは、肝臓以外の組織、特に、心筋、脳、末梢血リンパ球、線維芽細胞(繊維芽細胞)に発現している。
肝臓は、ケトン体を合成(産生)する酵素活性(HMG-CoAシンターゼ)は高いが、ケトン体を代謝する酵素(SCOT)の活性は低い。
SCOTは、ケトン体のアセト酢酸をスクシニル-CoAと反応させ、アセトアセチル-CoAとコハク酸に変換させる。アセトアセチル-CoAは、更に、チオラーゼ(ミトコンドリアアセトアセチル-CoAチオラーゼ:T2)により、2分子のアセチル-CoAに分解される。
アセト酢酸−(SCOT)→アセトアセチル-CoA−(T2)→アセチル-CoA
SCOTは、ケトン体(アセト酢酸)が、アセチル-CoAに分解(開裂)されるのに必要な酵素だが、肝臓は、SCOTを有していないので、肝臓で産生したケトン体をアセチル-CoAに再分解して利用出来ない。
SCOTは、肝臓以外の全ての組織に存在する。肝臓以外の組織(脳、骨格筋、心筋、腎臓、副腎、腸など)は、肝臓で産生されたケトン体をアセチル-CoAに分解して、燃料分子として利用出来る。
SCOT欠損症やT2欠損症(ミトコンドリアアセトアセチル-CoAチオラーゼ欠損症)では、ケトン体が、肝外組織に取り込まれないので、ケトン体が血中に増加する(ケトーシス)。
SCOT欠損症は、間歇期には、持続性ケトーシスが存在しても、無症状(ミトコンドリア内、チオラーゼがT2の他にも存在するので、T2欠損症では、持続性ケトーシスを来たさない)。
SCOT欠損症は、感染や飢餓を契機に、強いケトーシス発作(ケトアシドーシス発作)を来たし、最悪の場合、死亡する。
SCOT欠損症は、ケトーシス発作時、嘔吐、筋緊張低下、意識障害、多呼吸(代謝性アシドーシスの呼吸で代償する為)などが見られる。
SCOT欠損症は、アセトン血性嘔吐症(自家中毒症)に類似したケトーシス発作を起こす。
SCOT欠損症は、2歳以前に発症する。アセトン血性嘔吐症は、殆どは、2歳以降に発症する。
SCOT欠損症では、発作時、通常、低血糖は、見られない。高アンモニア血症、高乳酸血症も、見られない。尿酸は、高値を示す。
SCOT欠損症は、飢餓や感染などの発作時には、ブドウ糖輸液を行い、脂肪酸のβ-酸化によるケトン体の生成(ケトーシス)を抑制する。
SCOT欠損症は、ケトン体を末梢組織(心筋、脳など)が利用出来ず、血液中にケトン体が蓄積し、間欠的に重篤なケトアシドーシスを来たす。
ケトン体は、末梢組織で、アセト酢酸−(SCOT)→アセトアセチル-CoA−(ミトコンドリアアセトアセチル-CoAチオラーゼ:T2)→アセチル-CoAと変換され、TCA回路で代謝される(肝臓は脂肪酸のエネルギーをケトン体として肝外組織に輸送させる)。
SCOTは、心筋において最も強く発現している。SCOTは、脳(大脳、小脳)、腎臓、副腎、リンパ球にも強く発現し、骨格筋、膵臓、肺、繊維芽細胞(弱い)にも発現が見られる(T2=ミトコンドリアアセトアセチル-CoAチオラーゼも発現している)。心臓や脳は、グルコースのみでなく、ケトン体をもエネルギー源として利用する(脳は、グルコース以外には、ケトン体が唯一のエネルギー源となる)。骨格筋は、単位重量当りのSCOT発現量は少ないが、総重量が多いので、ケトン体を多く消費すると考えられている。
SCOT欠損症では、十分にグルコースが供給されない飢餓時などには、心臓や脳でケトン体が利用されず、エネルギー代謝に障害が生じてしまう。
SCOT欠損症やT2欠損症は、ケトン体利用障害の為、幼少時期には、ケトアシドーシスを来たし易い(低血糖症も来たし得るが発作時の低血糖は稀)。
血中の遊離脂肪酸/総ケトン体比は、SCOT欠損症では、空腹(絶食)早期から0.3以下に低下する。遊離脂肪酸/総ケトン体比は、脂肪酸代謝異常症(FAOD)では、24時間空腹負荷後に高値を示す(2.6以上)。
SCOT欠損症は、常染色体劣性遺伝形式をとる。
SCOT欠損症の約4割の症例は、新生児時期に初回発作を来たす。新生児時期以後は、生後6カ月以降に、発作を来たすことが多い(母親からの移行抗体が低下し感染を来たし易くなる時期)。
SCOT欠損症は2歳以前に発症することが多く、アセトン血性嘔吐症は、2歳以降に発症することが多い。
SCOT欠損症の発作では、嘔吐、筋緊張低下、さまざまな程度の意識障害、多呼吸が見られる。
SCOT欠損症の発作時のアシドーシスは、アセトン血性嘔吐症やケトン血性低血糖症より、程度が強い(pH=7.20以下になる)。血液ガスpHが、7.30以下の場合は、SCOT欠損症の可能性を疑う。
SCOT欠損症の発作では、低血糖の頻度は少なく、高アンモニア血症、高乳酸血症も、認められない。
SCOT欠損症では、心筋のケトン体利用障害の為、心拡大(心肥大)が見られることがある。
SCOT欠損症は、有機酸分析では、特異的に異常値を示す有機酸はない。
SCOT欠損症の治療として、空腹時間を短くすることが大切で、夜の間食(夜食)も有効。高炭水化物食、軽度の蛋白制限食も有効と言われる。
胃腸炎などの食事摂取不能時や、感染時(発熱による異化亢進時)には、早期にブドウ糖輸液を行い、ケトアシドーシスを予防する。
SCOT欠損症の発作時(ケトアシドーシス時)は、ケトン体の産生を抑制するために、十分にブドウ糖を補給することと、アシドーシスの補正を行う。重炭酸ナトリウム(メイロン)は、過剰に静脈注射すると、高ナトリウム血症(高Na血症)を来たし、脳内出血を起こすおそれがある。
SCOT欠損症は、加齢と共に、発作を来たし難くなる傾向があると言われ、小児時期の早期に、正確な診断や治療を受ける必要がある。
SCOTは、ホルモンによる発現を調節する機構は、知られていない。
SCOT欠損症では、発育(発達)は、通常、遅滞しない。
SCOT欠損症では、ケトーシスは顕著でも、低血糖は、通常見られない。
SCOT欠損症では、血中アミノ酸は、正常。
SCOT欠損症や、T2欠損症(ミトコンドリアアセトアセチル-CoAチオラーゼ欠損症)は、末梢組織でのケトン体利用に必要な酵素が欠損し、間歇的にケトアシドーシスによる発作(嘔吐、意識障害など)を来たす。
T2(ミトコンドリアアセトアセチル-CoAチオラーゼ)は、肝臓で、acetoacetyl-CoA(アセトアセチル-CoA)を2分子のacetyl-CoA(アセチル-CoA)に変換する。T2は、また、イソロイシンの代謝に関して、2-methylacetoaccetyl-CoAをacetyl-CoA(アセチルCoA)とpropionyl-CoAとに分解する反応も触媒する。T2欠損症の典型例(酵素の残存活性が無い症例)では、尿有機酸分析を行うと、非発作時にも、有機酸(tiglyglycine、2-methyl-3-hydroxybutyrate、2-methylacetoacetate、注8)の尿中排泄増加を示す。T2欠損症の典型例では、血液濾紙によるアシルカルニチンが、特異的なパターン(C5:1やC5-OHが増加)を示す。しかし、非典型例(酵素の残余活性が有る症例)では、非発作時(発作間欠期)に、尿有機酸や、血液濾紙アシルカルニチンパターンが、軽度の異常しか示さず、見逃される可能性がある。
T2欠損症は、ケトアシドーシスの程度が軽く、新生児期に症状(発作)が現れることは稀で、初回発作は、生後6カ月から2歳の間に起こす。
T2欠損症は、正常に発達する症例が多い。
SCOT欠損症もT2欠損症も、非発作時は、無症状。
SCOT欠損症とT2欠損症の相違点として、SCOT欠損症は新生児期に初回発作を起こすことが多い(約半数)が、T2欠損症は新生児期に発作を起こすことは稀で、T2欠損症は持続的なケトアシドーシスを起こさないのが一般的。T2欠損は、(末梢組織での)ケトン体利用のみならず、(肝臓での)ケトン体産生にも、影響すると考えられている。
ミトコンドリアには、β-酸化に関与する中鎖3ケトアシル-CoAチオラーゼ(T1)も存在し、T1がT2欠損症では、ケトン体産生に際して、十分に、T2の代役を担うので、T2欠損症でも、ケトアシドーシスが起こる。T1は、肝臓以外にも、肝外組織にも存在しているので、T2欠損症でも、acetoacetyl-CoAがacetyl-CoAへ変換される。その為、SCOT欠損症の典型例(完全欠損例)では、持続的にケトアシドーシスを示すが、T2欠損症の典型例(完全欠損例:酵素の残存活性が無い症例)では、通常、発作間欠期のケトン体は、正常範囲を示す。
SCOT欠損症とT2欠損症は、酵素診断(酵素活性測定)により、鑑別される。
アセトン血性嘔吐症(周期性嘔吐症)やケトン性低血糖症は、ケトン体産生が亢進して、ケトアシドーシスになり、発作を起こす。
SCOT欠損症は、ケトン体産生が亢進した際に、ケトン体の利用が障害されて、ケトアシドーシスになり、発作を起こす。
アセトン血性嘔吐症、ケトン性低血糖、SCOT欠損症は、同様な誘因(飢餓、過労、ストレス、感染症など)で起こるが、SCOT欠損症は、アセトン血性嘔吐症などより、アシドーシスの程度が強い。アセトン血性嘔吐症、ケトン性低血糖、生理的アシドーシスでは、血液ガスでpHは7.25以下になることはないが、SCOT欠損症は、ケトン体利用が障害され、血液中にケトン体が増加するので、アシドーシスの程度が強く、容易に7.2以下になる。
7.その他
・アセトン血性嘔吐症(周期性嘔吐症)の患者は、将来、片頭痛に移行することが多い。
ミトコンドリア遺伝子異常症であるミトコンドリア脳筋症(MELAS)では、突発性の嘔吐発作を繰り返す。ミトコンドリア脳筋症(MELAS)の患者は、片頭痛の合併が見られる。
・アセトン血性嘔吐症(周期性嘔吐症)は、52〜54%の患者は、母親からの遺伝と考えられる。
アセトン血性嘔吐症(周期性嘔吐症)は、先天的(遺伝的)なミトコンドリア異常を有する児に起こると考えられる。
・難治性癲癇の治療に、ケトン食療法が試みられて来た。
飢餓療法(ケトン食療法)が、癲癇発作を抑制することがあることは、大昔より、知られて来た。
古典的ケトン食療法は、炭水化物に厳重に制限して行った(高脂肪・低炭水化物食)。近年は、MCTオイル(medium
chain triglyceride oil)を用いたケトン食療法も試みられた。
ケトン食療法中による癲癇発作抑制効果は、血液中のβ-ヒドロキシ酪酸(D-β-hydroxybutyrate:BHB)濃度の上昇と関連している。脳が、β-ヒドロキシ酪酸をエネルギー源として利用する程、痙攣が抑制される。MCT投与マウスは、飢餓マウスと同情、時間と共に、血中のβ-ヒドロキシ酪酸濃度が上昇する。
ケトン食療法中は、脳は、グルコース(ブドウ糖)より、ケトン体をエネルギー源として利用する(metabolic
shift)。
マウスの実験結果からは、ケトン食(ケトン乳)を投与すると、脳内ATP含量が増加し(脳内ADP含量は減少する)、神経細胞膜の膜安定化が起こり、刺激閾値が上昇し、痙攣が抑制されると考えられている。
表2 ケトン食投与マウスの脳内ATP含量(参考文献の表1を引用)
| 食事 |
ATP
(μ moles/wet g) |
ADP
(μ moles/wet g) |
| 対照群 |
1.756±0.127 |
0.400±0.067 |
| 飢餓群 |
1.883±0.156 |
0.376±0.067 |
| ケトン食群 |
2.068±0.243 |
0.377±0.065 |
ケトン食療法の副作用として、嘔吐、下痢、腹痛が現われることがある。
ケトン食療法中に、ビタミンB1(チアミン)を欠乏し、視神経萎縮を来たした症例がある。ケトン食療法中は、ビタミン剤を補充する必要がある。
・ケトン体が血中に増加する病態(ケトーシス)では、血中Na濃度が低下する(低Na血症)。
注1:アセトン血性嘔吐症は、大正3年に、伊東祐彦教授によって、自家中毒症と命名された。
以前は、アセトン血性嘔吐症(自家中毒症)の原因に関して、代謝障害説より、食物アレルギー説を支持する学者がいた。これは、自家中毒症は、眼瞼周囲の異常着色(アレルギー・シャイナー)、皮膚掻痒等、アトピー性素質(アトピー性皮膚炎)を有する小児に、多く発症したことが、理由だったと思われる。
自家中毒症は、都会に多く、田舎に少ない傾向があった。
注2:自家中毒症(アセトン血性嘔吐症)では、嘔吐に伴ない、茶褐色のコーヒー残渣様の吐物が見られることがあった。その為、自家中毒症(アセトン血性嘔吐症)は、血液吐瀉症とも呼ばれたが、近年は、そのような重症例は、減少していると言われる。
自家中毒症(周期性嘔吐症)の病理所見では、胃や十二指腸に、粘膜下出血、糜爛、潰瘍等の変化を認めると言う。
自家中毒症(周期性嘔吐症)の病理所見で、肝臓や腎臓に、脂肪変性が認められた例もあったとされる(現在のFAODの症例だった可能性も考えられる)。
注3:脂肪酸のエネルギーは、β-酸化により取り出され、糖新生(グルコース生成)のエネルギー源になる。しかし、脂肪酸(脂肪酸のβ-酸化で生成されるアセチル-CoA)が、実質的に、糖(グルコース)に変換されることは、ない。なお、脂肪酸の大部分は、偶数の炭素原子から構成されているが、腸内細菌(ヒトの大腸や、反芻動物の胃の中の微生物)等は、奇数鎖脂肪酸を合成する。奇数鎖脂肪酸(プロピオニル基)は、スクシニル-CoAを経て、オキサロ酢酸に代謝されるので、奇数鎖脂肪酸は、例外的に、実質的に、糖(グルコース)に変換される。
注4:肝臓では、脂肪酸のβ-酸化によって生成されるアセチル-CoAは、大部分は、本来、TCA回路で代謝される。
「脂肪は、糖の炎によって燃える」(Fat burns in a carbohydrate flame)と言われるように、脂肪酸のβ-酸化によって生成されるアセチル-CoAが、TCA回路で代謝されるには、糖(グルコース)の代謝(解糖)で生成されるオキサロ酢酸と結合し、クエン酸になる必要がある。
絶食時には、脂肪酸のβ-酸化が、亢進するが、解糖(グルコース異化作用)は低下し、ピルビン酸から、ピルビン酸カルボキシラーゼ(PC)によるオキサロ酢酸分子の生成も、低下する。特に、炭水化物の摂取が不足していると、オキサロ酢酸の生成が減少し、脂肪酸のβ-酸化によって生成されるアセチル-CoAを、TCA回路で十分に代謝出来ず、アセチル-CoAが蓄積し、ケトン体の生成が、亢進すると考えられる。なお、筋肉量が少なかったり、蛋白質の摂取が不足して、糖原性アミノ酸(アラニン等)が不足すると、糖新生に必要なオキサロ酢酸が不足し、低血糖を招くと考えられる。従って、ケトン性低血糖症(アセトン血性嘔吐症)の予防には、高蛋白・高炭水化物食(a high-protein, high-carbohydrate diet)が、良い。
注5:ケトン体をアセチル-CoAに合成する酵素としては、スクシニル-CoAトランスフェラーゼやチオラーゼが必要。
スクシニル-CoAトランスフェラーゼ((スクシニルCoA-3-オキソ酸CoAトランスフェラーゼ、succinyl-CoA:3-oxo-acid CoA-transferase:SCOT、EC-Number 2.8.3.5、thiophorase)は、アセト酢酸(ケトン体9を、スクシニル-CoAと反応させ、アセトアセチルCoAとコハク酸とに変換する酵素で、肝臓以外の全ての組織の細胞に存在する。チオラーゼは、アセトアセチルCoAを、2分子のアセチル-CoAに変換する酵素で、生成されたアセチル-CoAは、肝臓以外の組織(筋肉、脳等)の細胞のTCA回路で、代謝される。
なお、肝臓以外の細胞で、β-ヒドロキシ酪酸がアセト酢酸に変換される際には、肝臓と異なるアイソザイムのβ-ヒドロキシ酪酸デヒドロゲナーゼ(HBDH:β-
Hydroxybutyrate Dehydrogenase、EC 1.1.1.30)が、触媒する。
HMG-CoAシンターゼは、アセチル-CoAをアセトアセチル-CoAに結合させ、3-ヒドロキシ-3-メチルグルタリルCoA(HMG-CoA)を生成する。
肝臓は、ケトン体を合成(産生)する酵素活性(HMG-CoAシンターゼ)は高いが、ケトン体を代謝(アセチル-CoAに分解する)する酵素活性(スクシニル-CoAトランスフェラーゼ)は低い。HMG-CoAシンターゼ(HMG-CoA
synthase:EC 2.3.3.10)は、肝細胞のミトコンドリア内にのみ存在し、他の組織の細胞には、存在しない(ケトン体を産生して血液中に放出する臓器は、肝臓だけ)。
スクシニル-CoAは、ケトン体分解を促進させる:スクシニル-CoAは、肝臓以外の組織で、ケトン体(アセト酢酸)がスクシニル-CoAトランスフェラーゼによりアセトアセチル-CoAに変換される反応に必要。
スクシニル-CoAは、ケトン体生成を抑制する:スクシニル-CoAは、肝臓でケトン体生成に必要なHMG-CoAシンターゼを可逆的に阻害する(HMG-CoAシンターゼを共有結合修飾でスクシニル化する)。
注6:ケトン体は、肝臓以外の組織(骨格筋、脳等)のミトコンドリア内で、アセチル-CoAに変換され、エネルギー源(代謝燃料)として、利用される。ケトン体は、肝臓では、アセチル-CoAに変換(再分解)されて、利用されない:肝臓には、ケトン体(アセト酢酸)をアセトアセチル-CoA(チオラーゼによりアセチル-CoAに分解される)に変換する酵素(スクシニル-CoAトランスフェラーゼ)が存在しない。
ケトン体から生成されるアセチル-CoAは、ミトコンドリア内のTCA回路で代謝され、生成されるNADH2+等により、呼吸鎖でATPが生成される。これらの代謝過程に於いて、ビタミンB1(ピルビン酸デヒドロゲナーゼの補酵素であり、ピルビン酸のアセチル-CoAへの変換を促進させる)は、TCA回路の代謝を促進させ、ケトン体の利用(糖代謝)を促進させると考えられる。また、ビタミンB2(FADを構成し、脂肪酸のβ-酸化等を促進させる)、ビタミンB6(ASTやALTの補酵素であり、アラニン等のアミノ酸のピルビン酸への変換等を促進させる)、ビオチン(ピルビン酸カルボキシラーゼの補酵素であり、ピルビン酸のオキサロ酢酸への変換を促進させる)は、糖新生を促進させ、血糖上昇を促進させると考えられる。
アセトン血性嘔吐症(自家中毒症)は、末梢組織でのケトン体の利用傷害(ビタミン類の不足等が背景に存在する)の為に、ケトアシドーシスを起こし、嘔吐を繰り返す症状が主体になり、アセトン血性低血糖は、肝臓での糖新生の障害(アラニン等の糖新生に必要な炭素骨格の不足が背景に存在する)の為、低血糖を起こし、低血糖の症状(顔色不良、意識障害)が主体となっているのかも知れない。欧米では、アセトン血性低血糖(ketogenic
hypoglycemia)と言う病名は存在するが、アセトン血性嘔吐症(cyclic vomitting)と言う病名は、存在しないと言うような話を聞いたことがある。アセトン血性低血糖は、アラニン等の糖新生に必要な炭素骨格の不足が原因で、糖新生が十分に行われないこと(低血糖)が、発症の原因であり、アセトン血性嘔吐症は、糖新生時、脂肪酸のβ-酸化が亢進して生成されたケトン体を、末梢組織(骨格筋、脳等)で、ビタミン類(日本人に不足しがちだったビタミンB1)の不足が原因で、十分に利用出来ず、ケトン体が血中に著増すること(ケトアシドーシス)が、発症の原因なのかも知れない。
肝臓では、脂肪酸のエネルギーを、β-酸化により、グルコースや(糖新生)、ケトン体に変換し、他の組織で、代謝燃料として、利用することが出来るようにする。脂肪酸のβ-酸化によって、生成されたケトン体が、肝臓以外の組織(筋肉等)で、アセチル-CoAに変換され、TCA回路で代謝されるには、グルコースから生成されるオキサロ酢酸や、ビタミン類が必要であり、低炭水化物食や、ビタミン類の不足は、肝臓以外の組織でのケトン体利用を低下させ、血中にケトン体を蓄積させ、アセトン血性嘔吐症を招くのかも知れない。従来、アセトン血性嘔吐症で、血中のケトン体が増加するのは、肝臓で、中毒性物質により、(糖代謝が阻害され、)脂肪酸が不完全燃焼(不完全酸化)する結果、ケトン体産性が亢進すると言う説も、本に書かれていたが、アセトン血性嘔吐症で、血中のケトン体が増加しケトアシドーシスを来たすのは、肝臓からのケトン体生成が亢進する(糖新生の為の脂肪酸のβ-酸化が亢進したり異常を来たす)のが原因ではなく、肝臓以外の組織でのケトン体利用が障害される(肝外組織のTCA回路でのケトン体を代謝する能力が低下してる)のが、原因なのかも知れない。
なお、糖尿病では、インスリン不足により、脂肪酸放出が促進し、かつ、TCA回路の代謝や、脂肪酸合成が低下している為、アセチル-CoAが蓄積し、ケトン体が増加する(ケトーシスになる)。
注7:アセトン血性嘔吐症の治療として、ケトアシドーシスを改善する為に、メイロン(炭酸水素ナトリウム液)を加えることもあった(20%ブドウ糖液20〜60ml+メイロン20〜40ml)。
メイロンには、重炭酸イオン(HCO3-)が、7%液は0.833mEq/ml、8.4%液は1mEq/ml、含まれているが、非常に高濃度である(7%液は833mEq/L、8.4%液は1000mEq/L)ので、希釈(2%以下)して、緩徐(1mEq/分以下)することが望ましい(静脈注射でなく、ソリタT1号等の点滴液に添加して点滴注射で使用する)。
糖尿病のケトアシドーシスの場合、重炭酸(メイロン)を投与すると、CNSアシドーシスを来たし、中枢神経系障害の原因となると言う。
糖尿病のケトアシドーシスの場合、点滴(輸液)とインスリン治療により、ケトン体が、減少すると、アシドーシスも改善する。糖尿病のケトアシドーシスの場合、炭酸水素ナトリウム(メイロン)を投与すると、血糖値が正常化するに従い、アルカローシスと低K血症が起こり、呼吸抑制が起こり、動脈血CO2濃度が上昇するおそれがあるので、原則として、炭酸水素ナトリウム(メイロン)は、投与しない。
なお、1%ブドウ糖液(1,000mg/dL)は、浸透圧は、約55mOsm/Lなので、20%ブドウ糖液は、浸透圧は、約1110Osm/Lと高張液(生理食塩液に対する浸透圧比は、4〜5)。
20%ブドウ糖液(ブドウ糖4g/20mL)は、pHは、3.5〜6.5 (グルコース液の最も安定なpHは、3〜4と言われるが、滅菌に伴ない着色が生じない為に、pH3.5〜6.5に、調節されている)。この程度のpHだと、アセトン血性嘔吐症のアシドーシス(ケトアシドーシス)を増悪させるより、低血糖を改善し、脂肪酸のβ-酸化を抑制し、ケトン体の生成を抑制し、アシドーシスを改善する効果の方が、強いものと思われる。50%ブドウ糖液は、pHは3.5と酸性だが、滴定酸度(pH7.4にするのに要するNaOH量)は0.61と小さいので、血液中では、容易に緩衝されると言う。アミノ酸液は、pHは6程度だが、滴定酸度は約30と大きい。
注8:引用した深尾敏幸氏の総説には、2-methy-acetoacetateと記載。
参考文献
・川勝岳夫:アセトン血症(アセトン血性嘔吐)、小児疾患診療のための病態生理、小児内科、Vol.21臨時増刊号、333-337、1989年(東京医学社).
・川勝岳夫:アセトン血症嘔吐症、小児薬物療法の実際、小児内科、Vol.20臨時増刊号、217-219、1988年.
・鈴木紘一、他:ホートン生化学 第3版(東京化学同人、2005年、第3刷).
・ヴォート生化学(東京化学同人、2003年、第4刷).
・ハーパー・生化学(丸善株式会社発行、1975年).
・菊池方利:肝における糖調節機構について 日本醫事新報 No.4184(2004年7月3日)、21-30頁.
・田川邦夫:からだの働きからみる代謝の栄養学 タカラバイオ株式会社(2003年).
・吉田一郎:周期性嘔吐症、今日の小児治療指針 第4版、160-161、1982年(医学書院).
・大塚親哉:周期性嘔吐症、今日の小児治療指針 第11版、207頁、1997年(医学書院).
・松村龍雄:周期性嘔吐症または自家中毒症、小児科学、701-704、1975年(医学書院).
・田澤耕作:周期性嘔吐症、実践 小児診療 日本医師会雑誌 特別号 Vol.129
No.12、S163-S164、2003年.
・貴田嘉一:小児における糖尿病の治療、糖尿病診療マニュアル、日本医師会雑誌、特別号、Vol.130
No.8、S202-S207、2003年.
・上田英雄、他:内科学(第四版、1987年、朝倉書店).
・山田研太郎:急性合併症のための検査と処置、糖尿病診療マニュアル、日本医師会雑誌、特別号、Vol.130
No.8、S230-S233、2003年.
・児玉浩子、金子衣野、疋田敏之:周期性嘔吐症−片頭痛関連疾患として、日本医事新報、No.4311(2006年12月9日)、57-62頁.
・高田哲、中山慎一、横山純好、中村肇:ケトン食療法の理論と実際、特集 West症候群(点頭てんかん)−最近の進歩、小児内科、Vol.23
No.9、106-110頁、1991年(東京医学社).
・児玉荘一:小児てんかんの治療 ケトン食療法、小児内科、Vol.16 No.4、19-23頁、1984年(東京医学社).
・深尾敏幸:総説 ケトン体代謝異常症:特にアセトン血性嘔吐症と鑑別すべきサクシニル-CoA : 3-ケト酸CoAトランスフェラーゼ(SCOT)欠損症を中心に、日本小児科学会雑誌、111巻6号、727-739頁、2007年.
・Mark A. Sperling: Chapter 77 hypoglycemia, Nelson Textbook of Pediatrics
(15th edition), 420-430, 1996.
・Iraj Rezvani, David S. Rosenblatt: Chapter 85.6 Valine, leucine, isoleucine, and related organic acidemias, 540-549, Nelson Textbook of Pediatrics (18th Edition, 2007).
|トップページ|脂質と血栓の関係|ミニ医学知識|生化学の知識|医学の話題|小児科疾患|生命の不思議|リンク集|


