



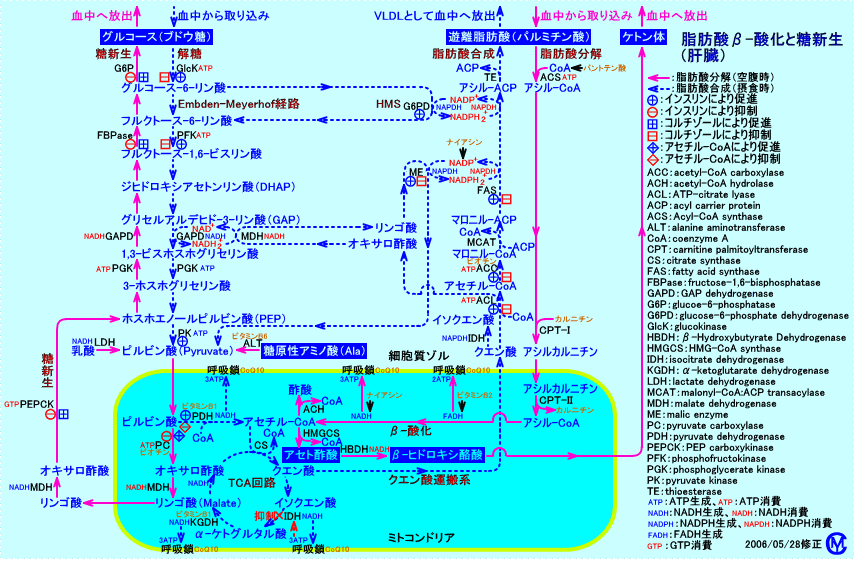
脂肪酸の合成
【ポイント】
摂食時には、グルコース(ブドウ糖)のエネルギーが、解糖により、脂肪酸合成に利用され、脂肪酸として蓄えられる。そして、空腹時には、脂肪酸のエネルギーが、脂肪酸分解により、肝臓での糖新生(グルコースの再生)に利用されたり、筋肉でのATP生成(運動エネルギー産生)に利用される。
脂肪酸合成に必要なNADPHの約半分は、糖の代謝の側路(HMS)から供給される。
糖分(砂糖など)を摂取し過ぎると、脂肪酸合成が行われ、肥満になり易い。
脂肪酸合成に必要なアセチル-CoAは、糖(グルコース)の代謝以外に、アミノ酸の代謝からも供給される。
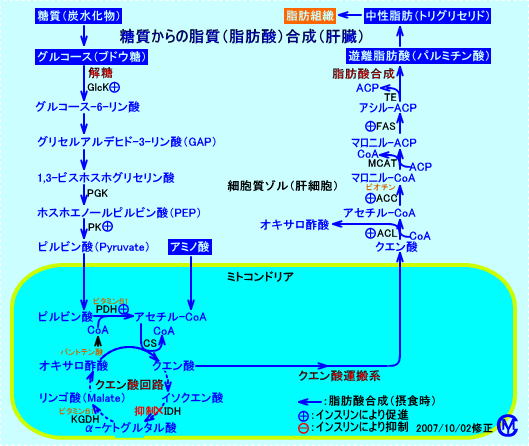
脂肪酸合成は、肝臓、腎臓、脳、肺、乳腺、脂肪組織など、多くの組織のミトコンドリア外(細胞質ゾル)で、マロニル-CoA経路で、行われる。なお、嫌気状態では、ミトコンドリア内でも、長鎖脂肪酸(主に、C18のステアリン酸、C16のパルミチン酸、それと、若干のC20やC14の脂肪酸)に、アセチル-CoA基が、添加(結合)される。
脂肪酸合成は、細胞質ゾル(cytoplasm)で行われ、脂肪酸分解(β-,酸化)は、ミトコンドリア内で行われる。
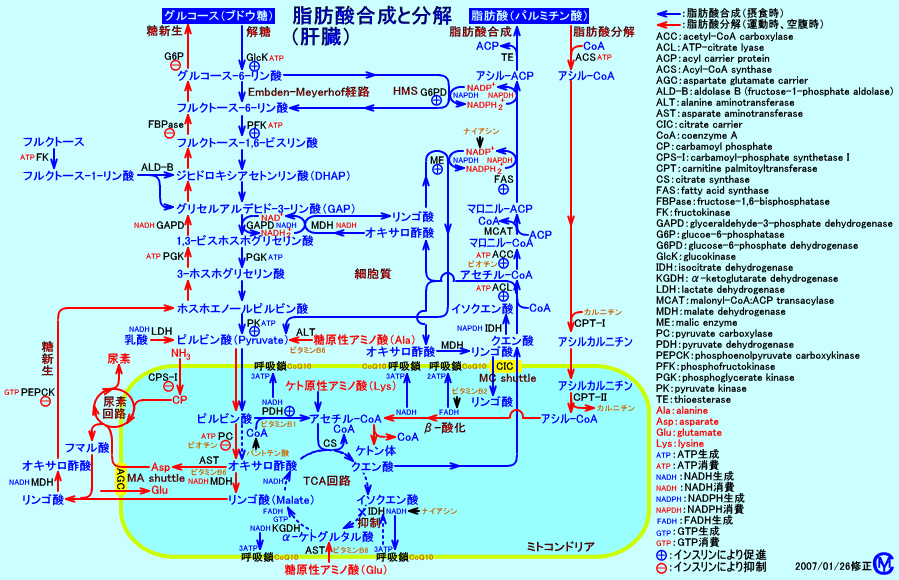
1.脂肪酸合成
糖質(グルコース)や蛋白質(アミノ酸)が代謝され、ミトコンドリア内で、アセチル-CoAが生成される。
アセチル-CoAは、クエン酸シンターゼ(citrate synthase)により、クエン酸に変換され、TCA回路で代謝(燃焼)されると、NADH2+が生成され、呼吸鎖でATPが生成される。
食事摂取時に、過剰な栄養が摂取され、十分にATPが生成されていると(運動時でなくATP需要が少ない時)TCA回路のイソクエン酸デヒドロゲナーゼの酵素活性が、抑制される。
ATPにより、イソクエン酸デヒドロゲナーゼの酵素活性が抑制されると、TCA回路での代謝が抑制され、クエン酸がミトコンドリア内に蓄積する。
蓄積したクエン酸は、ミトコンドリアのマトリックスから細胞質ゾルに輸送され、ATP-citrate lyase(クエン酸リアーゼ:肝臓に多く発現している)により、アセチル-CoAに戻される。
細胞質ゾルで、アセチル-CoAは、マロニル-CoA経路で、活性化されたアセチル-CoAカルボキシラーゼ(ACC)により、マロニル-CoA(malonyl-CoA)となり、アシル-ACP(Acyl-ACP)を経て、パルミチン酸(palmitate)などの脂肪酸に合成される。
糖質(グルコース)の代謝でエネルギー(ATP)が十分に産生されず、AMPが増加すると、AMPは、ACCの活性を抑制し、アセチル-CoAからの脂肪酸合成が抑制される。
肝臓では、合成された脂肪酸は、グリセロール3-リン酸(α-グリセロリン酸:グルコースから変換される)と、エステル結合し、トリグリセリド(中性脂肪)となり、VLDLとして、血中に分泌される。
脂肪酸合成は、肝臓、腎臓、脳、肺、乳腺、脂肪組織など、多くの組織で行われる。
特に肝臓は、脂肪酸合成に関与する酵素の活性が、高い。肝臓では、肝臓で合成した脂肪酸や、脂肪組織から血中を輸送された遊離脂肪酸や、食事由来の遊離脂肪酸を、グリセロール3-リン酸にエステル結合させ、トリグリセリド(中性脂肪)を合成する。肝臓では、合成したトリグリセリドを、同じく、肝臓で合成したコレステロールと共に、VLDLとして、血中に分泌する。
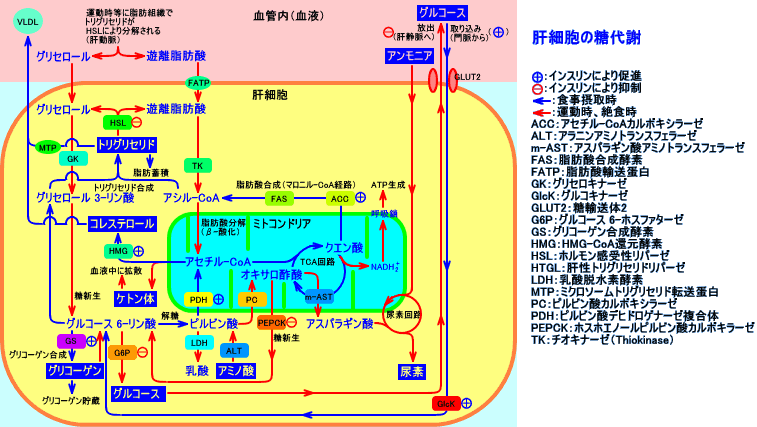
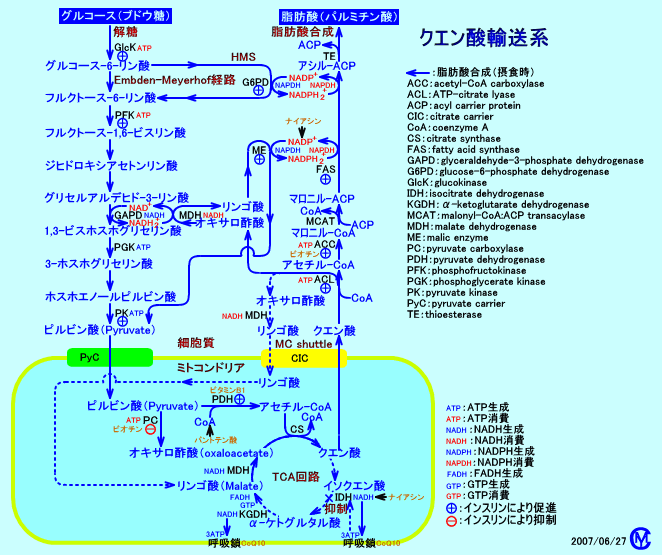
2.脂肪酸合成は、解糖系と共役している
脂肪酸合成には、解糖系(アセチル-CoAやATPを供給する)と、ホスホグルコン酸回路(HMS:NADPH2+を供給する)が、協調して働く。
肝臓の肝細胞内で、ブドウ糖(グルコース:分子量180)は、脂肪酸(パルミチン酸:分子量807)に変換(転換)される。パルミチン酸1分子を生成するのには、グルコース18分子が消費される(グルコース重量の28%が脂肪酸になる。ブドウ糖50gを過剰に摂取した場合、脂肪14gが生成される(デンプン100gを過剰に摂取した場合、脂肪30gが生成される)。糖分(砂糖など)を摂取し過ぎると、脂肪酸合成が行われ、肥満になり易い。
肝臓では、過剰に摂取したグルコースは、脂肪酸合成と、グリセロール 3-リン酸生成に利用され、トリグリセリド合成が高まり、VLDLとして、肝静脈中に分泌される。
脂肪酸合成は、細胞質ゾルで、アセチル-CoAを原料にして、行われるが、NADPHが必要。
アセチル-CoA + 7 マロニル-CoA + 14 NADPH + 14 H+ → パルミチン酸 + 7CO2 + 14 NADP+ + 8
CoASH + 6 H2O
パルミチン酸(C16:0)は、長鎖脂肪酸伸長酵素ELovl-6(the elongation of
long-chain fatty acids family member 6)により、ステアリン酸(C18:0)に変換される。
ステアリン酸(C18:0)は、ステアリン酸脱飽和酵素により、オレイン酸(C18:1)に変換され、中性脂肪として、肝臓から、分泌される。
脂肪酸合成に際して、脂肪酸の還元に必要なNADPHは、ミトコンドリア外(細胞質ゾル)で、ホスホグルコン酸回路(HMS:約60%)、リンゴ酸酵素(malic enzyme:約40%)による反応、イソクエン酸デヒドロゲナーゼによる反応により、供給される。そう言う面で、脂肪酸合成は、解糖系と、共役している。
NADPHを供給するホスホグルコン酸回路(HMS:ペントースリン酸経路)は、脂質形成(lipogenesis)が活発な、肝臓、脂肪組織、授乳中の乳腺などで、活発に働いている。
リンゴ酸酵素は、ミトコンドリア外(細胞質ゾル)で、リンゴ酸を、ピルビン酸に変換する。
malate + NADP+ ⇔ pyruvate + CO2 + NADPH
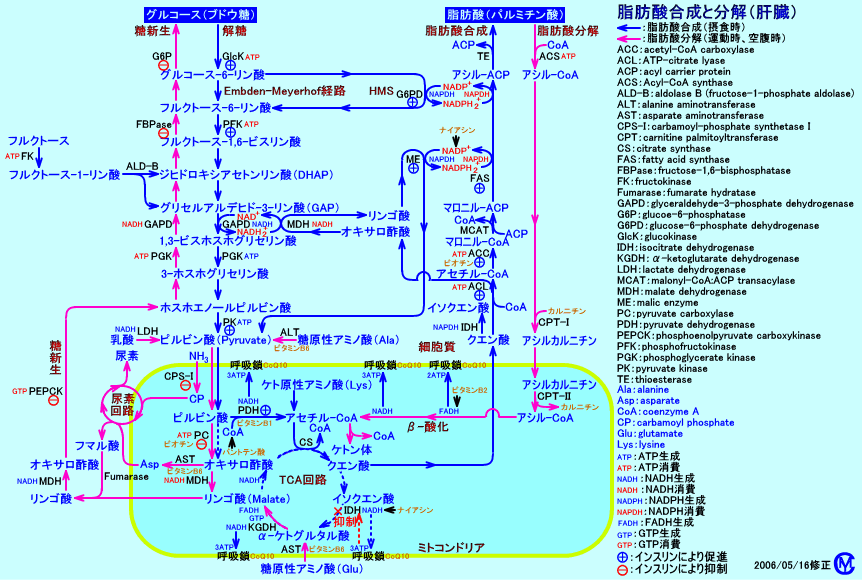
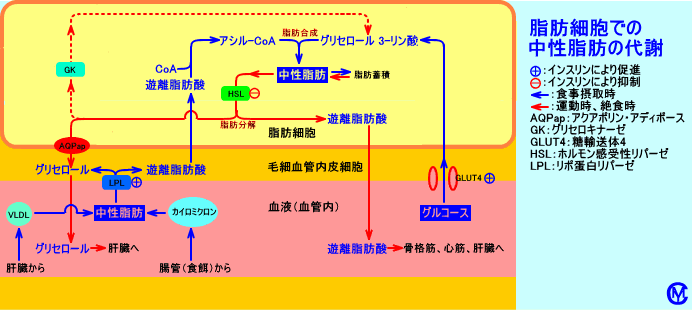
3.褐色脂肪細胞
一般的に、脂肪細胞(脂肪組織)と言うと、皮下や内臓周囲に存在する白色脂肪細胞(白色脂肪組織)を意味するが、肩甲骨間、腋下部、腎周囲などには、褐色脂肪細胞が存在する。褐色脂肪細胞は、量が少ない(体重の1%以下)。
白色脂肪細胞は単房性に脂肪滴を含む、褐色脂肪細胞は多房性に脂肪滴を含む。
白色脂肪細胞はミトコンドリア数が少ないが、褐色脂肪細胞はミトコンドリア数が多い。
白色脂肪細胞は、中性脂肪を貯蔵する役割が主。
褐色脂肪細胞は、脂肪をβ-酸化(脂肪燃焼)し、生成されるエネルギーを共役的にATP生成に利用しないで(脱共役)、熱産生に用いる。
glycerokinase(グリセロールを、グリセロール-3-リン酸にする酵素)の活性は、白色脂肪細胞では低いが、褐色脂肪細胞では高い。白色脂肪細胞は、中性脂肪をHSLで分解して生成されるグリセロールは、細胞外に輸送される(脂肪酸は、グルコースの取り込み量が少ない時には細胞外に輸送され、グルコースの取り込み量が十分な時にはグリセロール-3-リン酸と再エステル結合され、中性脂肪になる)。
褐色脂肪細胞は、脂肪酸合成を盛んに行う。褐色脂肪細胞に含まれる(貯蔵されている)中性脂肪は、大部分は、細胞自身が、血中のグルコースを原料に合成された中性脂肪と言われる。白色脂肪細胞も、脂肪酸合成を行うが、貯蔵されている中性脂肪は、肝臓で合成された中性脂肪が多い。褐色脂肪細胞は、グルコースを取り込んで、グルコースから脂肪酸合成を行ったり、グルコースをグリセロール-3-リン酸に変換したり、中性脂肪の分解で生じるグリセロールをglycerkinaseによりグリセロール-3-リン酸に変換することで、中性脂肪を合成する。
4.その他
脂肪酸合成(lipogenesis:fatty acis synthesis)は、グルコース、ピルビン酸、アセチル-CoAなどのような中間体を、脂肪酸に変える。
脂肪酸合成の度合いは、炭水化物含量の高い食事を十分に摂っていると高い。反対に、脂肪酸合成の度合いは、アトキンズ・ダイエット(Atkins
Diet)のように、脂肪含量の高い食事を食べて、しかも、摂取カロリー(熱量)を限定している人(減少させている人)や、糖尿病などインスリンが不足している人では、低い。
高蛋白食をすると、アラニン、バリン、システイン、メチオニンなどのアミノ酸が、血中に増加し、これらのアミノ酸は、脂肪細胞において、脂肪合成を抑制し、脂肪の蓄積を阻害する。高淡白食は、高脂肪食、高糖質食に比し、体重の増加が、著しく抑制される。蛋白質を摂取すると、尿素回路での尿素処理にATPを必要とするので、高蛋白食は、肝臓や腎臓に負担がかかり、カロリーをロスする。
アセチル-CoAカルボキシラーゼ(ACC)は、アセチル-CoAをマロニル-CoAにする酵素で、脂肪酸合成の速度を制御する(制限酵素)。ACCは、ビタミンのビオチンを補酵素として必要とする。
ACCの活性は、長鎖アシル-CoA(Acyl-CoA)により、競合阻害される。ACCの活性は、クエン酸により、アロステリックに、活性化される。
組織(細胞の細胞質ゾル)に遊離脂肪酸が流入し、Acyl-CoAが蓄積すると、ACCの活性が阻害(抑制)され、新しい脂肪酸の合成が、阻害される。
摂取カロリーの減少、脂肪含量の多い食事の摂取、糖尿病などは、血漿中の遊離脂肪酸を増加させ、ACCの活性を阻害し、脂肪酸合成を低下させる。
インスリンは、細胞内cAMP濃度を低下させ、ホルモン感受性リパーゼ(HSL)の活性を抑制し、ACCの活性を抑制する脂肪酸(長鎖アシル-CoA)の濃度を低下させ、脂肪酸合成(結果的にはトリグリセリドの合成)を、促進させる。インスリンは、ピルビン酸デヒドロゲナーゼ(PDH)を活性化させ、アセチル-CoAの生成を促進させ、クエン酸が、脂肪酸合成に利用されることを促進させる。
Hill等の実験(1958年)によれば、食事中(食料中)に、わずか、2.5%の脂肪が含まれているだけで、肝臓での脂肪酸合成(lipogenesis)が、低下する。
脂肪の平均総貯蔵量は、成人男子では体重の15%、成人女子では体重の25%と言われる。
脂肪組織は、過剰に摂取されたグルコースから生成された脂肪酸(細胞毒性がある)を、トリグリセリド(無毒)として、貯蔵している。
脂肪組織は、必要な時に、脂肪酸をエネルギー源として放出し、グリセロールをグルコース源(糖新生の原料)として、放出する。
脂肪酸合成には、ナイアシン(NADH2+やNADPH2+の合成に必要)、パントテン酸(CoAの合成に必要)、ビオチン(ACCの補酵素)、ビタミンB1(PDHの補酵素)などのビタミンが、必要。
脂肪酸分解には、ナイアシン(NADH2+の合成に必要)、パントテン酸(CoAの合成に必要)、カルニチン(アシル-CoAがミトコンドリア内に入るのに必要)、ビタミンB2(FADH2の合成に必要)などのビタミンやCoQ10(呼吸鎖を形成する)が、必要。
糖新生には、ナイアシン(NADH2+の合成に必要)、ビオチン(PCの補酵素)、ビタミンB6(ALTの補酵素)などのビタミンが、必要。
蛋白質に含まれるアミノ酸の内、ケト原性アミノ酸は、主として、アセチル-CoAやアセト酢酸に変換され、脂肪酸合成やケトン体の生成に利用される。糖原性アミノ酸は、主として、糖新生に利用される。
脂肪酸合成に際して、ミトコンドリア内のアセチル-CoA(糖質の分解によって蓄積する)は、クエン酸シンターゼ(CS)によりオキサロ酢酸と結合し、クエン酸として、細胞質ゾルに輸送される。
クエン酸は、細胞質ゾルで、クエン酸リアーゼ(ATP-citrate lyase)によりオキサロ酢酸とアセチル-CoAとに戻される。
オキサロ酢酸は、リンゴ酸デヒドロゲナーゼ(MDH)によりリンゴ酸に変換(NADH2+により還元される)される。
リンゴ酸が、リンゴ酸酵素(ME)によりピルビン酸に変換される(NADPH2+が生成される)。
このピルビン酸が、ミトコンドリア内に輸送されると、正味、細胞質ゾルでは、NADH2+からNADPH2+への変換が行われたことになる。
参考文献
・鈴木紘一、他:ホートン生化学 第3版(東京化学同人、2005年、第3刷).
・ヴォート生化学(東京化学同人、2003年、第4刷).
・ハーパー・生化学(丸善株式会社発行、1975年).
・田川邦夫:からだの働きからみる代謝の栄養学 タカラバイオ株式会社(2003年).
・小松啓子、山岸稔:肥満児に対する新しい栄養・運動療法の試み 小児科 Vol.27 No.5、551-559、1986年.
・島野仁:肥満とメタボリックシンドローム、Astellas Square、14-15頁.
|トップページ|脂質と血栓の関係|ミニ医学知識|生化学の知識|医学の話題|小児科疾患|生命の不思議|リンク集|


