





不飽和脂肪酸
脂肪酸の炭素間に、二重結合(注1)を有するのが、不飽和脂肪酸。
不飽和脂肪酸は、細胞膜の流動性を上昇させる。
ヒトでは、リノール酸(n-6系)と、α-リノレン酸(n-3系)が、必須脂肪酸。
1.多価不飽和脂肪酸には、n-6系と、n-3系がある
二重結合を複数有する多価不飽和脂肪酸には、n-6系とn-3系がある。
脂肪酸を構成する炭素を、メチル基(末端メチル炭素:ω-炭素)の方から数えて、最初の炭素をn-1、2番目の炭素をn-2と数える。
n-6系とは、メチル基の方から調べて、最初に存在する二重結合が、n-6の炭素(C-13)とn-7の炭素(C-12)の間に存在する多価不飽和脂肪酸のこと。
n-3系では、最初の二重結合が、n-3の炭素とn-4の炭素の間に存在する。
最近は、脂肪酸の炭素の二重結合の場所は、n-系を用いて、例えば、リノール酸は、(6,9)と示す:炭素n-6とn-7の間と、n-9とn-10との間に、二重結合があることを意味する。リノール酸は、短絡表記では、18:2Δ9, 12と表らわされる(18: 2; 9, 12と表らわされた時代もあった)。
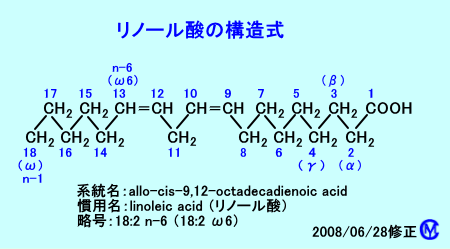
なお、カルボキシル炭素(Carboxyl炭素)の方から数えるIUPAC(International
Union of Pure and Applied Chemistry:国際純正・応用化学連合)の方式では、カルボキシル基の炭素がNo.1(C-1)で、その隣り(次)の炭素原子はNo.2(C-2)だが、α-炭素とも呼ばれる。カルボキシル基から一番離れた炭素(末端メチル炭素)は、ギリシャ文字のωが用いられる。
二重結合は、普通、鎖の末端(末端メチル炭素)から、3、6、9番目の炭素原子、つまり、n-3(ω3)、n-6(ω6)、n-9(ω9)に存在する。
n-6系の多価不飽和脂肪酸(ω6脂肪酸)は、リノール酸(C18:2、LA)→γ-リノレン酸(GLA)→ジホモ-γ-リノレン酸(DGLA)→アラキドン酸(C20:4、AA)と代謝される。
n-6系の多価不飽和脂肪酸は、主としてリノール酸として摂取され、生体内では、アラキドン酸に代謝される。アラキドン酸は、細胞膜や血漿中では、リン脂質として、存在する。
アラキドン酸からは、血小板では、トロンボキサン合成酵素により、血小板凝集促進作用があるTXA2が生成される。
同じアラキドン酸から、血管内皮細胞では、血小板凝集阻止作用があるPGI2が生成される(同じ材料から、同じ代謝経路で、反対の作用を示す生理活性物質が産生されることは、生命の恒常性を保つために、好都合な仕組みと、思われる。)
n-3系の多価不飽和脂肪酸(ω3脂肪酸)は、α-リノレン酸(C18:3、ALA)→→(エ)イコサペンタエン酸(EPA:eicosapentaenoic acid、C20:5)→ドコサヘキサエン酸(DHA:docosahexaenoic acid、C22:6)と代謝される。
n-3系の多価不飽和脂肪酸には、抗血栓作用や、VLDL低下作用がある。また、末梢組織のインスリンを高める作用がある。
n-3系の多価不飽和脂肪酸を含有する魚油カプセルを、単独、あるいは、ビタミンEとともに内服させると、心筋梗塞の発作の再発が予防される。
n-3系の不飽和脂肪酸のEPAが、血小板で代謝されて生成されるトロンボキサンA3(TXA3)は、アラキドン酸が代謝されて生成されるTXA2と異なり、血小板凝集作用や、血管平滑筋収縮作用が無いとされている。
実際、EPAを含む魚食により、血小板凝集能が抑制される。多血小板血漿に、EPA(僅か1mmol/L)を先に添加すると、アラキドン酸による血小板凝集が、抑制される。漁村に住んでいる人は、山村に住んでいる人に比して、血中EPA/AA比(血中EPA/アラキドン酸比)が高い:血中EPA/AA比は、漁村の人では2.0、山村の人では0.2、都会の人では0.4。EPAを摂取すると、食後に血中EPA濃度が上昇するが、アラキドン酸(肉など)を摂取しても、食後に血中アラキドン酸濃度は、変化しない:血中EPA/AA比は、EPAを摂取すると、食前には0.4〜0.6だった人が、食後3〜5時間後には、1.8程度に上昇する。魚を食べている漁民は、動脈硬化症にはなるが、血小板凝集は、抑制されている。EPAによる血小板凝集抑制作用は、4日間程度持続するが、野菜(ホウレンソウ)の血小板凝集抑制作用は、5〜6時間程度しか持続しない。
EPAからは、COX-1により、PGI3も生成されるが、PGI3には血小板凝集抑制作用がある。
魚油(EPAやDHAを含む)を、成人の喘息患者に投与すると、臨床症状は改善しないが、多核白血球のEPAは上昇し、アラキドン酸は減少し、LTB4、C5aは減少すると言う。
n-6系のアラキドン酸からは、PGI2、LTB4、TXA2(血小板凝集促進作用がある)が生成され、n-3系のEPAからは、PGI3、LTB5、TXA3(血小板凝集促進作用がない)が生成される。
不飽和脂肪酸は、小腸粘膜の細胞膜の電気抵抗を減少させる:不飽和脂肪酸は、細胞膜の流動性を上昇させる。低温環境に生息する深海性魚類などは、細胞膜に不飽和脂肪酸を多く含み、低温でも、細胞膜の流動性が保たれる。逆に、飽和脂肪酸は、細胞膜の電気抵抗を増加させ、細胞膜の流動性を減少させる。
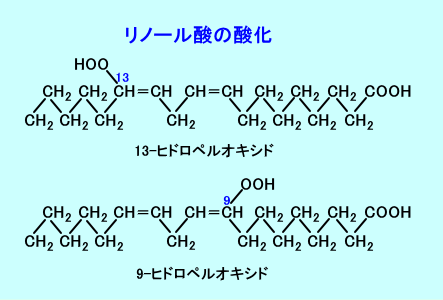
二重結合を有する多価不飽和脂肪酸は、食品中でも生体内でも、酸化されやすいので、ビタミンCやビタミンEなどの抗酸化ビタミンを、同時に摂取する必要がある。
食品中に多価不飽和脂肪酸の酸化を防止するために、酸化防止剤(BHT、ビタミンE、ビタミンCなど)が添加される。
n-3系の多価不飽和脂肪酸は、免疫抑制的に作用する。
T細胞のIL-2産生や、増殖反応、細胞障害T細胞活性などは、n-3系の多価不飽和脂肪酸を摂取すると、低下する。
マクロファージからの、IL-1α、IL-1β、TNF-αの産生は、 n-3系の多価不飽和脂肪酸を1日2.7g、連続4週間摂取すると、低下する。
NK細胞活性は、脂肪摂取を制限すると、増強する(脂肪摂取を全エネルギーの22%以下にする)。また、NK細胞活性kは、高脂肪食、特に、n-3系の多価不飽和脂肪酸を多く含む魚油を摂取すると、低下する。
n-3系の多価不飽和脂肪酸は、細胞膜の臨脂質の組成を変化させ、細胞膜の流動性を変化させる(流動性を上昇させる)。
リノール酸、アラキドン酸、EPA、DHAなどの多価不飽和脂肪酸は、いろいろな食品に、含まれている。
表1 脂肪酸100g当りの多価不飽和脂肪酸含有量(g)
| 食品名 |
n-6系多価不飽和脂肪酸 |
n-3系多価不飽和脂肪酸 |
| リノール酸 |
アラキドン酸 |
リノレン酸 |
イコサペンタエン酸 |
ドコサヘキサエン酸 |
| LA |
AA |
ALA |
EPA |
DHA |
| 18:2 |
20:4 |
18:3 |
20:5 |
22:6 |
| カステラ |
16.5 |
0.2 |
0.5 |
|
1.7 |
| かわらせんべい |
22.5 |
1.4 |
0.9 |
|
1.4 |
| あじ焼き |
22.0 |
1.7 |
0.9 |
8.1 |
15.3 |
| まいわし焼き |
2.2 |
1.0 |
0.9 |
12.6 |
12.2 |
| しらす干し |
1.0 |
2.0 |
1.1 |
13.5 |
28.2 |
| さけ新巻き焼き |
1.0 |
0.7 |
0.5 |
8.3 |
16.8 |
| さんま焼き |
1.5 |
0.6 |
1.1 |
6.1 |
9.9 |
| あさり生 |
0.8 |
4.3 |
0.5 |
7.0 |
11.3 |
| いか焼き |
0 |
2.8 |
0.2 |
14.0 |
37.9 |
| えびあまえび生 |
1.0 |
1.9 |
0.1 |
21.9 |
18.1 |
| 鶏若鶏ささ身 |
14.7 |
2.5 |
0.5 |
0.7 |
3.6 |
| 豚肝臓 |
15.3 |
17.0 |
0.3 |
0.7 |
4.6 |
| 鶏卵全卵生 |
13.4 |
1.7 |
0.3 |
0 |
1.8 |
| 人乳(母乳) |
15.0 |
0.5 |
2.1 |
0.1 |
0.5 |
2.必須脂肪酸
体内では、グルコース(ブドウ糖)が分解されて出来るacetyl-CoAから、ミトコンドリア外のマロニルCoA経路を経て、二重結合の無い飽和脂肪酸のパルミチン酸(C16:0)が、合成される。
体内(肝臓)では、飽和脂肪酸に1ケの二重結合を生じさせ、一価不飽和脂肪酸を作ることは出来る。
例えば、ステアリン酸(C18:0)が、オレイン酸(C18:1、注2)に、変えられる。
しかし、二重結合が二つ以上ある多価不飽和脂肪酸は、合成出来ないので、食事から補う必要がある。
このように食事から補う必要のある多価不飽和脂肪酸は、必須脂肪酸(あるいは、不可欠脂肪酸)と呼ばれる。
ヒトの必須脂肪酸は、最近は、リノール酸(n-6系)とα-リノレン酸(n-3系)とされる。
アラキドン酸、EPA、DHAも、他のアミノ酸や炭水化物からは合成できないので、広義の必須脂肪酸と呼ばれる。
FAO/WHOでは、必須脂肪酸(リノール酸、α-リノレン酸、アラキドン酸)を、最低、総エネルギーの4%摂取することを勧めている。
必須脂肪酸が欠乏すると、皮膚や毛髪を健康に保てなくなり、皮膚が乾燥肥厚し、表皮剥脱などが、生じる。
必須脂肪酸が欠乏すると、O-アシルセラミドのアシル部位(脂肪酸部位)が、リノール酸エステルから、オレイン酸エステルに、変化し、セラミドの皮膚バリアー機能も、減少してしまう。
なお、植物は、パルミチン酸(C16:0)→ステアリン酸(C18:0)→オレイン酸(C18:1)→リノール酸(C18:2)→α-リノレン酸(C18:3)と、多価不飽和脂肪酸を合成出来る。
必須脂肪酸や、ビタミンB6(ピリドキシン)や、ビタミンB5(パントテン酸)が欠乏すると、肝臓に脂肪蓄積が起こる(脂肪肝)。
3.摂取する食餌により、体内の脂肪酸の比率は、変わる
血液中の不飽和脂肪酸の比率は、摂取する食餌によって、変わる。
同じ、イヌイット(エスキモー)人でも、グリーンランドに在住している人たちと、デンマークに在住している人たちでは、前者の方が、血清中の(エ)イコサペンタエン酸(EPA)の量が多く、リノール酸の量は少ないことが判明している。
EPAの摂取過多は、脳出血などの出血性疾患発生のリスクがある。
ラットに、コーン油(リノール酸を多く含む)、大豆油(リノール酸に加え、α-リノレン酸を5%程度含む)、エゴマ油(リノール酸より、α-リノレン酸を多く含む)を脂質の原料とする食餌で、4週間飼育した実験結果では、
1.小腸粘膜リン脂質中のリノール酸量は、食餌の油の種類により、差がなかった。
しかし、小腸粘膜リン脂質中のアラキドン酸量は、コーン油や大豆油で飼育したラットに比べて、エゴマ油で飼育したラットは、少なかった。
2.小腸粘膜リン脂質中のα-リノレン酸とエイコサペンタエン酸の量は、コーン油<大豆油<エゴマ油の順に多かった。
脂肪酸の構成比を調べた報告では、アラキドン酸は、摂取食物中より血清中の比率が多く、血清中に蓄積される傾向にある。
また、脂肪組織中の不飽和脂肪酸の比率は、摂取する食事の質や量により変化する。
4.不飽和脂肪酸を摂取すると、コレステロールが低下するが、酸化LDLは増加する
食事でリノール酸を摂取すると、血清中のコレステロール(LDLとVLDL)やトリグリセリドが低下する。
しかし、食事で、不飽和脂肪酸を摂取し過ぎると、HDLが低下したり、酸化LDLが増加する。
近年、リノール酸などの不飽和脂肪酸を過剰に摂取することが、アレルギー性疾患の増加を招いているという、指摘もある。
また、リノール酸は、ある種の癌(乳癌、前立腺癌など)の発症を、増加させると考えられる。なお、女性では、動物性脂肪や、動物性脂肪の主要な構成成分の飽和脂肪酸や、一価不飽和脂肪酸の摂取は、結腸癌になるリスクを高める。しかし、女性に関しての研究では、植物性脂肪や、リノール酸の摂取は、結腸癌の発症と、関連が認められていない。
リノール酸から体内で誘導されるアラキドン酸からは、LTC4、LTD4、LTE4が生成される。LTC4、LTD4、LTE4は、毛細血管の透過性を亢進させ組織内に浮腫を誘導させたり、ヒスタミンより強力に気管支平滑筋を収縮させたりして、気管支喘息の気道炎症に関与する。
不飽和脂肪酸が多い食餌を摂取したラットのリンパ球は、強いリンパ球増殖反応を示す。
n-6系の不飽和脂肪酸は、IL-1などのサイトカインの産生を増加させる。
反対に、n-3系の不飽和脂肪酸は、サイトカインの産生を抑制して、アレルギー性疾患や自己免疫疾患の改善に有効とされるが、結核などの感染症に対する抵抗力を減弱させるおそれも指摘されている。
不飽和脂肪酸を与えた子ネズミは、飽和脂肪酸を与えた子ネズミより、寿命が半分くらいに短いと言う(注3)。
アラキドン酸やDHAは、血管内皮細胞を活性化させるという(EPAは、あまり、活性化させない)。
5.リン脂質
リン脂質(グリセロリン脂質)は、1分子のグリセロールに、2分子の脂肪酸と、1分子の燐酸と塩基などの化合物が、結合している。
塩基がコリン(注4)の場合は、レシチン(Lecithin、別名、ホスファチジルコリン:phosphatidyl choline:PtC、PC)と呼ばれる。
レシチン(ホスファチジルコリン)は、2分子の脂肪酸の部分(下図のR1とR2)は、疎水性で、グリセロールと、リン酸と、塩基(極性基)の部分は、親水性なので、二重層の細胞膜(脂質二重層)を形成する。
細胞膜は、主に、リン脂質(グリセロリン脂質)、コレステロール、スフィンゴ脂質から、構成されている:リン脂質は、袋状のミセルを形成し、コレステロールは、この構造を強化すると言われる。コレステロールは、動物の細胞膜に必須な成分:コレステロールは、動物の細胞膜を、強靭な膜にしている。細菌類の細胞膜には、一般的に、コレステロールが含まれず、細胞膜がリン脂質(構成する二本の脂肪酸は、パルミチン酸などの飽和脂肪酸)から構成されている為、柔軟性がなく、堅くて、脆い。
細胞膜を構成するリン脂質には、多価不飽和脂肪酸、特に、アラキドン酸が多く含まれており、活性酸素などにより、酸化されるおそれがある。
虚血などにより、細胞内Ca2+濃度が上昇し、ホスホリパーゼA2(PLA2)が活性化されると、細胞膜成分のリン脂質が分解され、アラキドン酸が遊離され、アラキドン酸の代謝過程(アラキドン酸カスケード)で、活性酸素が産生される(脳微小血管障害や脳浮腫の原因になる)。
食事などの影響で、血漿の脂質異常が生じ、細胞膜のリン脂質量やコレステロール量が変化すると、細胞膜の特性(流動性、透過性など)が、変化する可能性がある。
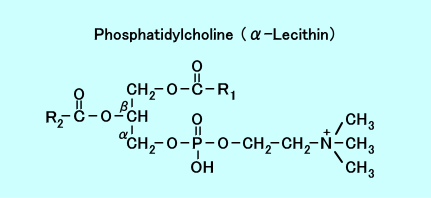
レシチンは、脳や神経、卵黄や大豆に多く含まれる。
レシチンは、血清リン脂質の70%を占める。
レシチンには、界面活性作用があり、血中のコレステロール値を低下させたり、血圧を低下させたり、血小板凝集を抑制する作用があるという。
細胞膜は、リン脂質が二重層になって構成されている:細胞膜の外側は、レシチン(ホスファチジルコリン)やスフィンゴミエリンが、多い。細胞膜の内側は、ホスファチジルエタノールアミンや、ホスファチジルセリンが、多い。
リン脂質は、体内細胞を構成している。
リン脂質のリン酸と塩基の化合物の領域は、親水性で、残りの領域は、疎水性になっている。 細胞膜は、2層のリン脂質によって構成されている:脂質二重層のリン脂質は、疎水性領域を向かい合わせて2層に並んで、細胞膜の外側と細胞質側に親水性領域を配置している。
血清リン脂質の大部分は、肝臓で合成される。
リン脂質は、脳や、精子などで、特に、糖質(グルコース)が欠乏した状態では、エネルギー源として、利用される。
必須脂肪酸(多価不飽和脂肪酸)は、細胞膜や、ミトコンドリア膜を、構成する。
必須脂肪酸は、リン脂質として存在(リン脂質を構成)し、多くの場合、リン脂質のβ位を、必須脂肪酸が占めている。
多価不飽和脂肪酸(リノール酸、アラキドン酸、リノレン酸など)は、多くの場合、グリセロールのβ位(中央のC2位)に結合し、リン脂質として存在している。
血漿中のリン脂質は、殆んどが肝臓で合成され、また、肝臓で、異化(分解)される。
肝細胞が障害される肝疾患では、血漿コレステロールエステル比が低下し、レシチン比が相対的に増加し、リゾレシチン比が、低下する。これは、レシチンのβ-位の脂肪酸を、遊離コレステロールに転移して、コレステロールエステルを生成する、LCATが、肝臓で、産生されない為、血漿中のLCAT活性が低下する為と言われる。
レシチン(ホスファチジルコリン)は、腸内細菌により、トリメチルアミンになる。トリメチルアミンは、余ったコレステロールを処理する食細胞(スカベンジャー細胞)を活性化させ、動脈にコレステロールが沈着し、動脈硬化が促進する。
肺サーファクタントの表面張力低下作用(表面活性作用)は、主に、リン脂質により、発揮される。肺サーファクタント中のリン脂質でも、特に、1,2位にパルミチン酸を有するジパルミトイルホスファチジルコリン(DPPC)が、重要な役割を、発揮する。
6.トリグリセリド(中性脂肪)
トリグセリド(triglyceride:TG)は、1分子のグリセロールに、3分子の脂肪酸が結合している。
トリグリセリドは、トリグリセライド、中性脂肪、トリアシルグリセロールとも呼ばれる。
トリグリセリド(中性脂肪)は、グリセロールの3つの水酸基に、それぞれ1つ、計3つの脂肪酸が、エステル結合している。
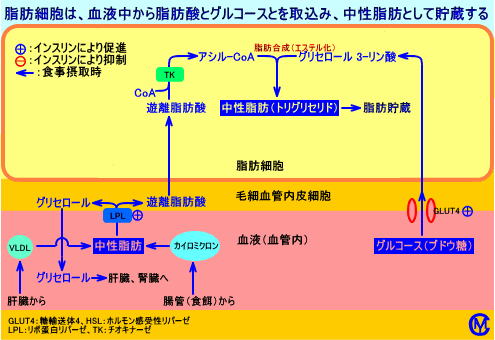
トリグリセリド(中性脂肪)は、体内で、ブドウ糖(グルコース)の代謝産物のグリセロール-3-リン酸(α-グリセロリン酸)か、ジヒドロキシアセトンリン酸(DHAP)と、脂肪酸が、エステル結合して、合成される(注5)。
トリグリセリド(中性脂肪)は、エネルギー供給源として、体内の脂肪組織や肝臓に、貯蔵される。
トリグリセリド(中性脂肪)は、結合している脂肪酸の大部分は、化学的に安定な飽和脂肪酸(パルミチン酸、ステアリン酸)や、一価不飽和脂肪酸(オレイン酸)で、多価不飽和脂肪酸(リノール酸)は少ない。
哺乳類のトリグリセリド(中性脂肪)は、エステル結合している脂肪酸は、飽和脂肪酸としてはパルミチン酸が多く、不飽和脂肪酸としてはオレイン酸やリノール酸が多い(注6)。
食事中のトリグリセリド(中性脂肪)は、ほぼ100%、腸管(小腸)から、吸収される。
食事中のコレステロールは、脂肪に溶けているか、胆汁酸に十分分散されているかにより、吸収率が異なる。ヒトでは、300mgの負荷では(300mg摂取させた場合)、50%吸収され、3,000mgの負荷では、7〜44%、吸収されるに過ぎない。
植物ステロール(β-シトステロールなど)は、5%程度しか、腸管から吸収されないが、コレステロールの吸収を阻害する(競合する)。
植物ステロールは、コレステロールの吸収を阻害し、LDL-コレステロールを抑制し、動脈硬化などを予防する「心臓に良い」成分として、添加している食品もある。しかし、植物ステロールは、血清中のコレステロールと同じ割合で、動脈硬化巣の動脈プラークに、蓄積する。
トリグリセリドは、筋肉の筋線維間(遅筋線維の間)にも存在し、運動時などに、ホルモン感受性リパーゼ(HSL)により分解され、エネルギー源として利用される。
中性脂肪(脂肪細胞の割合:体脂肪率)は、男性では体重の15〜20%、女性では体重の20〜2%と言われる。
肥満の人では、体重の30%以上が中性脂肪。
中性脂肪15kgには、人間が3カ月生きていけるカロリー量がある。
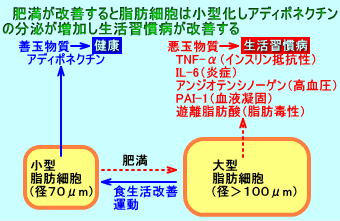
脂肪細胞を中性脂肪を貯蔵する燃料タンクとして機能する。
脂肪細胞は、アディポネクチンなど、様々な生理活性物質を産生する。
7.リゾホスファチジルコリン(LPC)
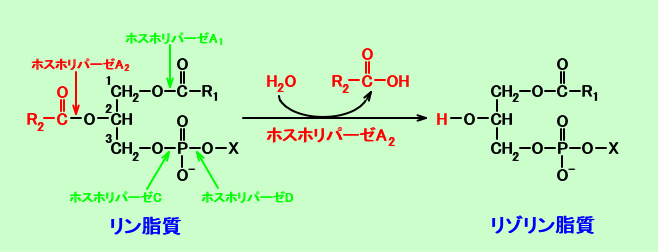
ホスホリパーゼA2(phospholipase A2:注7)は、リン脂質のレシチン(PC)のC2につく脂肪酸(β位の脂肪酸)を加水分解し、リゾレシチン、つまり、リゾホスファチジルコリン(LPC)が生成されるという。
LPCは、食品が空気中の酸素で劣化しても、生成される。
LPCの生成は、ビタミンEを食品に添加することで、抑制される。
肥満細胞(注8)は、刺激される(表面のIgE受容体に、抗原が結合して、架橋される)と、ホスファチジルセリン→ホスファチジルエタノールアミン→ホスファチジルコリン(レシチン)と生成され、カルシウムイオン(Ca2+)が細胞内に流入する。
ホスファチジルコリン(レシチン)は、ホスホリパーゼA2の作用で、リゾホスファチジルコリンにされ、細胞膜と顆粒膜の融合が促進され、脱顆粒が起こり、ヒスタミンなどが放出される。
蛇毒や細菌溶血毒も、ホスホリパーゼA2作用のある、レシチン分解酵素(レシチナーゼ)であり、レシチン(PC)から、C2につく脂肪酸1ケを加水分解して、LPCを生成し、溶血させるという。
他にも、レシチン(PC)から誘導される、血小板活性化因子(PAF)や、リゾホスファチジン酸 (LPA:LPCが、血漿中のりゾホスホリパーゼDにより加水分解されて生成される)には、血小板凝集作用がある。
また、レシチン(PC)を構成する不飽和脂肪酸が過酸化されて、PAF様の生理活性を有するリン脂質が生成される。この際、ドコサヘキサエン酸(DHA)で構成されるレシチン(PC)から、最もPAF様の生理活性が高いリン脂質が生成されるという。
8.過酸化脂質
不飽和脂肪酸の酸化生成物は、過酸化脂質と総称される。分子内にペルオキシド結合(-O-O-)を持つ。
過酸化脂質は、細胞膜を障害したり、動脈硬化の発症に関係する。
実際に、血液中の過酸化脂質は、心筋梗塞、急性期脳梗塞、糖尿病、急性肝炎、劇症肝炎、未熟児網膜症などで、増加している。
不飽和脂肪酸の摂取は、過量にならないようにすると同時に、抗酸化物質を十分に摂取することが、大切。
血液中の過酸化脂質値は、遊離脂肪酸が多い場合や、高トリグリセリド血症(高中性脂肪血症)では、高値を示す。
9.脂肪酸の摂取量と蓄積量
食事(食品)中には、C12:0(ラウリン酸)、C14:0(ミリスチン酸)、C16:0(パルミチン酸)、C16:1(パルミトレイン酸)、C18:0(ステアリン酸)、C18:1(オレイン酸)、C18:2(リノール酸)、C18:3(α-リノレン酸)などの脂肪酸が、多く含まれている。
血清中には、C16:0(パルミチン酸)、C18:1(オレイン酸)、C18:2(リノール酸)が多く存在する:C18:2(リノール酸)>C16:0(パルミチン酸)>C18:1(オレイン酸)の順に多い。血清中には、少量だが、C14:0(ミリスチン酸)、C16:1(パルミトレイン酸)、C18:0(ステアリン酸)、C18:3(γ-リノレン酸)、C20:4(アラキドン酸)、C20:5(EPA)、C22:5(ドコサペンタエン酸)、C22:6(DHA)も、存在する。
摂取した脂肪酸の量と、血清脂肪酸の量を比較すると、C16:0(パルミチン酸)、C18:1(オレイン酸)、C18:0(ステアリン酸)は、摂取した脂肪酸の量と、血清脂肪酸の量は、同程度。C12:0(ラウリン酸)、C14:0(ミリスチン酸)、C18:1(オレイン酸)は、摂取した脂肪酸の量より、血清脂肪酸の量が少ない(血中に蓄積しにくい)傾向がある。C18:2(リノール酸)、C20:4(アラキドン酸)、C20:5(EPA)、C22:6(DHA)は、摂取した脂肪酸の量より、血清脂肪酸の量が多い(血中に蓄積し易い)傾向がある。
脂肪組織の中性脂肪を構成する脂肪酸は、オレイン酸(C18:1)が多く、次いで、パルミチン酸(C16:0)、リノール酸(C18:2)が多い:体重70kgのヒトでは、脂肪組織の重量は、7.7kgある。その内、水分が23%、脂質(中性脂肪、リン脂質、コレステロール)が71%(=5.5kg)、蛋白質が6%、糖(質)が0.1%(=7.7g)、ヌクレオシドが0.1%、無機質が0.2%、とされる。脂肪組織の脂質(中性脂肪、リン脂質)を構成する脂肪酸の組成は、C14:0が3.1%、C16:0(パルミチン酸)が22.7%、C16:1が8.4%、C18:0が4.3%、C18:1(パルミチン酸)が45.4%、C18:2が9.6%、C18:3が0.7%、C20:1が0.9%。ただし、食事(食物)によって、脂肪組織の脂肪酸の組成は、変化することが知られている:脂肪組織に貯蔵された脂肪(中性脂肪や、リン脂質を構成する脂肪酸)の飽和の度合いは、摂取する食事(食餌)によって、変化する。
10.不飽和脂肪酸の所要量
厚生省の発表している、「第6次改定日本人の栄養所要量」によると、飽和脂肪酸(S)、一価不飽和脂肪酸(M)、多価不飽和脂肪酸(P)の望ましい摂取割合は、おおむね3:4:3を目安とする。
また、n-6系多価不飽和脂肪酸と、n-3系多価不飽和脂肪酸の比は、健康人では、4:1程度を目安とする。
リノール酸の所要量(必要量)は、総カロリーの0.5〜5%、脂質の0.1〜2%とされる。
11.遊離脂肪酸
血漿中では、脂肪酸は、多くは、エステル結合した形、つまり、グリセロールエステル(トリグリセリドやリン脂質)、コレステロールエステルで、リポ蛋白中に存在している(リポ蛋白を構成している)。しかし、エステル結合していない脂肪酸も存在し、遊離脂肪酸(free fatty acid:FFA)と呼ばれている。
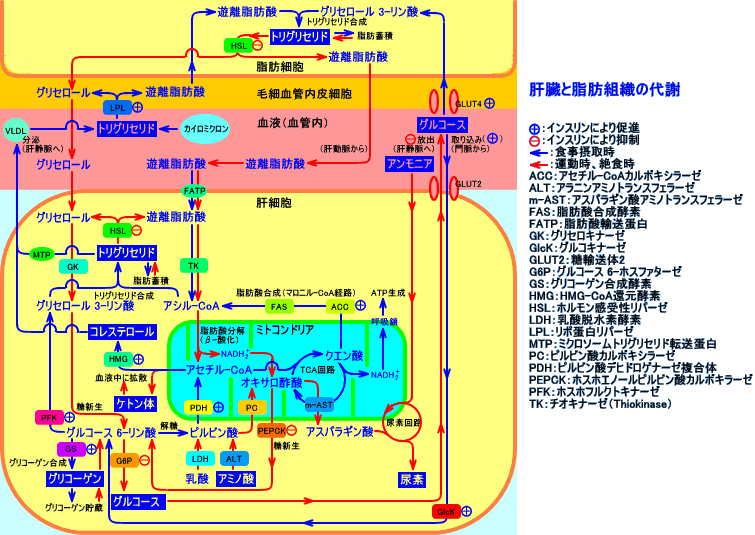
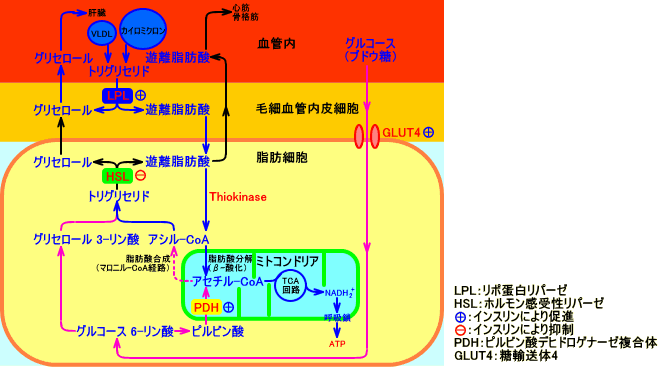
遊離脂肪酸は、脂肪組織で、トリグリセリドのホルモン感受性リパーゼ(HSL)による分解で生成され、血中を輸送され、筋肉(心臓、骨格筋)のエネルギー源として利用されたり、構築材料として利用される。
遊離脂肪酸は、細胞毒性(脂肪毒性:adipotoxicity)がある。遊離脂肪酸は、両親媒性の為、大量に存在すると、洗剤作用(界面活性作用)により、細胞膜を溶解させ、細胞を破壊する。必須脂肪酸の多価不飽和脂肪酸は、毒性が非常に高い。
余剰な遊離脂肪酸は、肝臓に取り込まれ、グルコースの代謝で生成されるグリセロール 3-リン酸とエステル結合し、(毒性の低い)トリグリセリドに戻され、リポ蛋白として、脂肪組織に、送り戻される。
肝臓でのトリグリセリド合成には、特に、食事(食餌)由来の遊離脂肪酸(FFA)が関与するが、脂肪組織由来の遊離脂肪酸(脂肪組織のトリグリセリドがHSLにより分解され生成される遊離脂肪酸)も、肝臓でのトリグリセリド合成、更には、肝臓からのVLDL分泌に影響する。
血清中では、遊離脂肪酸の70〜87%は、アルブミンに結合している。
血清中(血液中)の遊離脂肪酸の量は、脂肪組織での中性脂肪(トリグリセリド)の分解による遊離脂肪酸の放出と、肝臓での遊離脂肪酸の取り込みによって、調節されている。
遊離脂肪酸は、血液中のグルコース量(ブドウ糖濃度=血糖値)が不足した状況(飢餓時、絶食時、断食時など)では、グルコースに変わるエネルギー源として、利用される。
遊離脂肪酸は、血液中のグルコース量が不足した状況(飢餓時など)では、骨格筋、心臓、腎臓では、エネルギー源として利用され、また、肝臓では、糖新生のエネルギー源となる(脂肪酸のβ-酸化が行われる)。
正常男性(基礎代謝1,800kcal/日)が、24時間、絶食すると、脂肪組織で、中性脂肪が、ホルモン感受性リパーゼ(HSL)により、加水分解され、100gの遊離脂肪酸が生成される。その遊離脂肪酸の内、肝臓は、40g(20〜40%)を取り込み、脂肪酸分解(β-酸化)により生成するエネルギー(NADH2+など)を、糖新生に利用する。肝臓は、食事摂取を開始すると、血液中から取り込んだ遊離脂肪酸と、グルコースとから、中性脂肪を再合成し、リポ蛋白(VLDL)として、血中に放出する。
遊離脂肪酸の血漿中半減期は、1.7〜3.1分と短く、交替率は、23〜41%/分。
脂肪酸は、エネルギー需要の高い細胞(心筋細胞、骨格筋細胞など)に、取り込まれる。
脂肪酸は、容易に細胞膜を経て、細胞内(細胞質)に進入する。
脂肪酸は、細胞質から、ミトコンドリア内に入って、β-酸化され、アセチル-CoAとなって、TCA回路で代謝される。
脂肪酸(アシル-CoA)が、細胞質から、ミトコンドリア内に入るには、脂肪酸(アシル-CoA)が、カルニチンと結合して、アシルカルニチンになることが必要。
高トリグリセリド血症のある患者は、しばしば膵炎を合併する。その膵炎発症機序として、膵臓の毛細血管内で、リポ蛋白リパーゼ(LPL)の作用により、カイロミクロン中やVLDL中のトリグリセリドが加水分解され、生じる遊離脂肪酸により、微小血栓形成(第XI因子、第XII因子が活性化される)、毛細血管障害(Ca2+との結合、毛細血管内皮細胞への作用)による微小循環障害により、膵臓が障害され、膵リパーゼが放出されると言う。
脂肪細胞では、トリグリセリド合成に必要なアシル-CoAは、LPLにより生成された遊離脂肪酸や、グルコースが解糖されて生成されるアセチル-CoAから生成される:ヒトの脂肪細胞では、後者のアシル-CoA(グルコースが解糖されて生成されるアセチル-CoAから生成される脂酸)は、極めて少ない(注9)。脂肪細胞では、中性脂肪を合成する(組み立てる)が、中性脂肪の原料となる遊離脂肪酸(アシル-CoA)は、血中のカイロミクロンやVLDLの中性脂肪に由来し、脂肪細胞内で合成される遊離脂肪酸は、少ない(脂肪酸を合成する酵素活性は、肝臓が高い)。
血中の遊離脂肪酸は、脂肪組織(脂肪細胞内)に存在するホルモン感受性リパーゼ(HSL)により、脂肪細胞内のトリグリセリドが、分解されて生成されたり、あるいは、脂肪組織(脂肪組織に血液を供給する細小動脈や毛細血管の内壁)などの毛細血管壁に存在するリポ蛋白リパーゼ(LPL)により、血中のカイロミクロンやVLDL内のトリグリセリドが分解され生成され、血中に増加する。
遊離脂肪酸は、脂肪組織(の脂肪細胞内)に存在する、長鎖脂肪酸(パルミチン酸、ステアリン酸、リノール酸など)から構成されている。
遊離脂肪酸は、血中では、アルブミンと結合している。
遊離脂肪酸(FFA)は、脂肪(エステル化脂肪酸)と区別する為、非エステル化脂肪酸(NEFA)とも呼ばれる。
インスリンは、ホルモン感受性リパーゼ(HSL)活性を抑制する。
絶食時(飢餓時)や、糖尿病では、インスリン分泌不足の為、ホルモン感受性リパーゼ(HSL)活性が上昇し、血液中の遊離脂肪酸(FFA)濃度が、上昇する。
遊離脂肪酸は、臓器で代謝や中性脂肪合成に利用されないと、短期的には内臓脂肪に蓄積し、長期的には皮下脂肪に蓄積する。
遊離脂肪酸(FFA)も、脂肪細胞から産生される。血漿遊離脂肪酸(FFA)が上昇すると、筋肉細胞では、PI3-キナーゼ(PI3K)が低下し、グルコースの取り込みが低下する(Randle効果)。
高脂肪食負荷や遊離脂肪酸(FFA)は、インスリン抵抗性を惹起させる。血中の脂質や遊離脂肪酸が増加し、骨格筋や肝臓に中性脂肪が蓄積すると、中性脂肪やアシル-CoA(脂肪酸-CoA)により、PKCθ(protein kinase C θ)、IKKβ(I kappa B kinase)が活性化され、IRS(骨格筋ではIRS-1、肝臓ではIRS-2)のセリンリン酸化が起こる。その結果、インスリンによるIRSのチロシンリン酸化やPI3-キナーゼ(PI3K)の活性化などが阻害され、GLUT4の細胞膜への発現が低下し、細胞内への糖取り込みが低下する(インスリン抵抗性)。ストレスによって、副腎髄質などからアドレナリンが分泌されると、脂肪組織でホルモン感受性リパーゼ(HSL)により中性脂肪が分解され、血中に遊離脂肪酸が増加する(ストレスはインスリン抵抗性を惹起する要因になる)。
肥満を解消すると、インスリン抵抗性が改善する。

12.脂肪酸の合成
脂肪酸合成は、肝臓、腎臓、脳、肺、乳腺、脂肪組織など、多くの組織のミトコンドリア外(細胞質ゾル)で、マロニル-CoA経路で、行われる。なお、嫌気状態では、ミトコンドリア内でも、長鎖脂肪酸(主に、C18のステアリン酸、C16のパルミチン酸、それと、若干のC20やC14の脂肪酸)に、アセチル-CoA基が、添加(結合)される。
脂肪酸合成に際して、脂肪酸の還元に必要なNADPHは、ミトコンドリア外(細胞質ゾル)で、ホスホグルコン酸回路(HMS:約60%)、リンゴ酸酵素(malic enzyme:約40%)による反応、イソクエン酸デヒドロゲナーゼによる反応により、供給される。
NADPHを供給するホスホグルコン酸回路(HMS)は、脂質形成(lipogenesis)が活発な、肝臓、脂肪組織、授乳中の乳腺などで、活発に働いている。
リンゴ酸酵素は、ミトコンドリア外(細胞質ゾル)で、リンゴ酸を、ピルビン酸に変換する。
malate + NADP+ ⇔ pyruvate + CO2 + NADPH
脂肪酸合成(lipogenesis:fatty acis synthesis)は、グルコース、ピルビン酸、アセチル-CoAなどような中間体を、脂肪酸に変える。
脂肪酸合成の度合いは、炭水化物含量の高い食事を十分に摂っていると高い。反対に、脂肪酸合成の度合いは、アトキンズ・ダイエット(Atkins
Diet)のように、脂肪含量の高い食事を食べて、しかも、摂取カロリー(熱量)を限定している人(減少させている人)や、糖尿病などインスリンが不足している人では、低い。
アセチル-CoAカルボキシラーゼ(ACC)は、アセチル-CoAをマロニル-CoAにする酵素で、脂肪酸合成の速度を制御する(制限酵素)。
ACCの活性は、長鎖アシル-CoA(Acyl-CoA)により、競合阻害される。ACCの活性は、クエン酸により、アロステリックに、活性化される。
組織(細胞の細胞質ゾル)に遊離脂肪酸が流入し、Acyl-CoAが蓄積すると、ACCの活性が阻害(抑制)され、新しい脂肪酸の合成が、阻害される。
摂取カロリーの減少、脂肪含量の多い食事の摂取、糖尿病などは、血漿中の遊離脂肪酸を増加させ、ACCの活性を阻害し、脂肪酸合成を低下させる。
インスリンは、細胞内cAMP濃度を低下させ、ホルモン感受性リパーゼ(HSL)の活性を抑制し、ACCの活性を抑制する脂肪酸(長鎖アシル-CoA)の濃度を低下させ、脂肪酸合成(結果的にはトリグリセリドの合成)を、促進させる。インスリンは、ピルビン酸デヒドロゲナーゼを活性化させ、アセチル-CoAの生成を促進させ、クエン酸が、脂肪酸合成に利用されることを促進させる。
Hill等の実験(1958年)によれば、食事中(食料中)に、わずか、2.5%の脂肪が含まれているだけで、肝臓での脂肪酸合成(lipogenesis)が、低下する。
13.赤血球膜中の多価不飽和脂肪酸
成熟赤血球は、ミトコンドリアを失っているので、脂質合成能(脂肪酸合成能)はない。成熟赤血球は、血漿中の多価不飽和脂肪酸(PUFA)を、絶えず、取り込んでいるので、赤血球膜に含まれる多価不飽和脂肪酸は、長期間の血漿中の脂肪酸(濃度)を反映する。
母乳中の脂肪酸組成は、母親の食餌内容を反映する。
母親の食餌(栄養)は、1カ月乳児の赤血球膜脂質を構成する脂肪酸に、反映される。
赤血球膜に含まれるリノール酸(n-6系)量は、母親より、乳児の方が、少ない:赤血球膜のリノール酸(C18:2)量は、母親では8.86±1.30%なのに対して、乳児では7.96±1.76%。他方、リノール酸から誘導されるn-6系のアラキドン酸量やドコサテトラエン酸(C22:4、DTA)量は、母親より、乳児の方が、多い:赤血球膜のアラキドン酸(C20:4)量は、母親では11.01±1.99%なのに対して、乳児では13.12±2.61%。なお、赤血球膜のEPA(C20:5、n-3系)量は、母親では1.28±0.55%なのに対して、乳児では0.28±0.36%と、母親より、乳児の方が少ない。また、赤血球膜のDHA(C22:6、n-3系)量も、母親(5.68±2.06%)より、乳児(5.06±2.00%)の方が少ない。
14.月経周期の長さと多価不飽和脂肪酸
多価不飽和脂肪酸(PUFA)の摂取量が多いと、月経周期が短くなる傾向がある(多価不飽和脂肪酸のP
for trendは、0.03)。
月経周期が長い(無排卵の期間が長い)と、乳癌の発症リスクが、低下する(多価不飽和脂肪酸の摂取量が多いと、乳癌の発症リスクが、上昇することになる)。
一価不飽和脂肪酸の摂取量(や飽和脂肪酸の摂取量)は、月経周期の長さに、影響しない(P
for trendは、一価不飽和脂肪酸が0.52、飽和脂肪酸が0.16)。
総カロリー摂取量、大豆摂取量、食物繊維摂取量は、月経周期の長さに、影響しない(関連性が認められない:多価P
for trendは、総カロリー摂取量が0.53、大豆摂取量が0.35、食物繊維摂取量が0.80)。
注1:炭素原子間の二重結合(C=C)は、一つのσ結合と、一つのπ結合から、構成される。
炭素には、電子を蓄える性質がある。
注2:オレイン酸(C18:1)は、一価不飽和脂肪酸。
オレイン酸は、酸化されにくい。
オレイン酸は、コレステロール低下作用がある。リノール酸は、ある一定量以上をとると、HDLも低下させてしまい、結果的に、LDLが増加してしまうが、オレイン酸は、LDLのみを低下させるという。
オリーブ油(オリブ油:OLIVE OIL)は、オレイン酸を多く含む:78%が、オレイン酸で、残りは、n-6系不飽和脂肪酸(リノール酸が、8%)と、飽和脂肪酸。オリーブ油は、リノール酸の含有量が少ないので、アレルギー体質の人には、リノール酸の含有量が多いサラダ油などよりは、健康に良いかも知れないが、肥満で、カロリー制限が必要な人は、控えた方が良いと思われる。オリーブ油には、ポリフェノール類が含まれていて、口がヒリヒリする。ポリフェノール類は、オリーブ油の酸化を防止している。腸管からの脂肪の吸収に伴ない、リンパ管内を転送されるリンパ球数も、増加する。オリーブ油を腸管腔内に投与し、生体顕微鏡で観察すると、腸管からの脂肪吸収(脂肪の転送)に伴なって、リンパ管内に、リンパ球が増加する(リンパ球の転送が増加する)。
オリーブ油は、空腹時に、スプーン1〜2杯、飲むと、便秘が改善する。オリーブ油は、胆嚢の収縮作用や、小腸の蠕動運動の促進作用により、便塊が滑り易くする。
オリーブ油(オリブ油)は、少量の服用では腸内で石鹸とグリセリンとに分解され、大量の服用では大部分が乳剤になり(一部分は脂肪酸になる)、蠕動促進や便滑作用を起こし、緩下作用を現す。
オレイン酸が含まれる割合:オリーブ油=78%、菜種油=61%、サラダ油=45%、ゴマ油=39%、コーン油=31%。
注3:飽和脂肪酸に関しては、動物実験の結果で、飽和脂肪酸を摂取させた動物は、記憶テストで、低い成績を示し、神経の樹状突起の数や長さが、未発達であったと言う。
注4:コリンは、CH2CH2N+(CH3)3。コリンには、脂肪乳化作用がある。
塩基が、コリンのリン脂質は、ホスファチジルコリン(レシチン)。
塩基が、エタノールアミン(-CH2CH2NH2)のリン脂質は、ホスファチジルエタノールアミン。
リン脂質のリン酸と塩基の部分は、親水性で、他の部分は、疎水性。
注5:中性脂肪は、体内で、ブドウ糖(グルコース)の代謝産物のグリセロール-3-リン酸(α-グリセロリン酸)か、ジヒドロキシアセトンリン酸(DHAP)と、脂肪酸が、エステル結合して、合成される。
グリセロール-3-リン酸が豊富に存在する時には、生じた脂肪酸に相当する分量は、グリセロール-3-リン酸と、再エステル化され、中性脂肪(トリアシルグリセロール)に戻ります。グリセロール-3-リン酸が不足している時には、生じた脂肪酸は、遊離脂肪酸として、血中に放出されます。グリセロール 3-リン酸の前駆体は、グルコースなので、グルコースの吸収速度が、遊離脂肪酸の動員に、関連します。
グリセロール 3-リン酸は、グルコースから、解糖時に生成されます:グルコース→グルコース 6-リン酸→フルクトース 6-リン酸→フルクトース 1,6-ビスリン酸→ジヒドロキシアセトンリン酸(DHAP)→グリセロール 3-リン酸と、生成されます。
グリセロール 3-リン酸は、フルクトース(果糖)からも、生成されます:フルクトース→フルクトース 1-リン酸→グリセルアルデヒド→グリセロール→グリセロール
3-リン酸と、生成されます。フルクトースは、フルクトース 6-リン酸となって、解糖系にも、導入されます(糖新生の経路の図に示しました)。
なお、グリセロール-3-リン酸は、α-グリセロリン酸とも呼ばれて来ましたが、グリセルアルデヒド
3-リン酸(GAP)とは、異なります。ジヒドロキシアセトンリン酸(DHAP)は、グリセロール
3-リン酸に変換されます。
グルコースは、解糖時に、上に述べたように、DHAPを経由して、
・グルコース→グルコース 6-リン酸→フルクトース 6-リン酸→フルクトース
1,6-ビスリン酸→ジヒドロキシアセトンリン酸(DHAP)→グリセルアルデヒド 3-リン酸(GAP)→1,3-ビスホスホグリセリン酸(1,3-BPG)→
と分解される経路と、フルクトース 1,6-ビスリン酸から、DHAPを経由しないで、直接、グリセルアルデヒド
3-リン酸(GAP)に分解される、
・グルコース→グルコース 6-リン酸→フルクトース 6-リン酸→フルクトース
1,6-ビスリン酸→グリセルアルデヒド 3-リン酸(GAP)→1,3-ビスホスホグリセリン酸(1,3-BPG)→
と言う経路とがあります。
皮脂腺から分泌される皮脂は、血中の中性脂肪を原料に、分泌される。甘い物(糖分)を食べ過ぎると、血中に中性脂肪が増加して、皮脂の分泌が増加する。ビタミンB2は、皮脂腺からの皮脂の分泌量を制御している(抑制している)が、甘い物(糖分)を食べ過ぎると、糖分の分解の為、ビタミンB2が消費され、皮脂の分泌量が増加する。
注6:トリグリセリド(中性脂肪)に含まれる不飽和脂肪酸の比率は、動物によって異なる。
牛や豚の脂肪は、トリグリセリド(中性脂肪)に、飽和脂肪酸を多く含むが、鳥の脂肪は、トリグリセリド(中性脂肪)に、不飽和脂肪酸を多く含む。飽和脂肪酸:不飽和脂肪酸の比率は、牛肉45:55、豚肉40:60、鶏肉31:69(もも肉)。その為、脂肪の融点は、牛肉40〜50度、豚肉33〜46度、鳥肉30〜32度であり、動物によって、脂肪の固まり易さが異なる。
注7:ホスホリパーゼA2(ホスフォリパーゼA2:phospholipase A2:PLA2)は、下記のように、リン脂質のC2につく脂肪酸残基を加水分解し、リゾリン脂質を生成させる。リゾリン脂質は、界面活性作用があり、細胞膜を壊し、細胞を溶かす。
注8:肥満細胞は、ヒスタミン、プロスタグランジン、ロイコトリエン、PAFなどを産生する。
表2 肥満細胞の放出する化学伝達物質
| 作用 |
ヒスタミン |
SRS-A |
LTB4 |
PGD2 |
PAF |
| 平滑筋収縮 |
+ |
+++ |
+ |
++ |
++ |
| 血管透過性亢進 |
++ |
++ |
+ |
++ |
++ |
| 粘液分泌促進 |
+ |
++ |
− |
+ |
+ |
| 白血球走化 |
+ |
− |
+++ |
+ |
+ |
| 上皮細胞障害 |
+ |
+ |
− |
− |
++ |
| 神経刺激 |
++ |
++ |
− |
++ |
+ |
注9:生体では、ミトコンドリア外のミクロソームで脂肪酸が合成される。生体では、どの細胞でも、脂肪酸の炭素数が16に達すると、脂肪酸の合成は、止まってしまう。炭素数12や、炭素数14の脂肪酸も合成されるが、炭素数16を超える脂肪酸は、生体内では、合成されない。
参考文献
・矢田純一:アレルギーの発現機序とその制御 小児科 35:1167-1174, 1994.
・植田伸夫:脂肪酸代謝と肥満 小児科 31: 747-753, 1990年.
・板倉引重:飽和脂肪酸と不飽和脂肪酸の摂取量とその役割 Health & Meat '91(「食肉と健康に関するフォーラム」委員会).
・香川芳子:五訂食品成分表2005(女子栄養大学出版部、2005年).
・高脂血症診療のてびき 日本医師会雑誌 第108巻第13号 平成3年12月15日発行(付録)、厚生省・日本医師会 編.
・福井巌、他:脂質パラメーターのみかた 4.リン脂質 臨床医 vol.8 no.9:18-21,
1982年.
・多田紀夫:代謝異常と成因 2.VLDL 臨床医 vol.8 no.9:30-33, 1982年.
・松田幸次郎、他訳:医科生理学展望(原著6版、丸善株式会社 1975年).
・ハーパー・生化学(原著14版、三浦義彰監訳、丸善株式会社、 1975年).
・鈴木紘一、他:ホートン生化学 第3版(東京化学同人、2005年、第3刷).
・植物ステロールの食品添加に疑問 動脈プラーク中に蓄積と警告 Medical Tribune 2005年8月18日号、49頁.
・田川邦夫:からだの働きからみる代謝の栄養学 タカラバイオ株式会社(2003年).
・石崎由美子、他:乳児およびその母親の赤血球膜中のn-3、n-6系列多価不飽和脂肪酸含量 日本小児科学会雑誌 98巻8号、1560-1567、1994年.
・山口了三、五十嵐紀子、並木和子:こんな野菜が血栓を防ぐ、BLUE BACKS、1991年発刊(1999年、第12刷、講談社).
・松島照彦、寺本民生:遊離脂肪酸(FFA)、内科、61巻6号、1142頁、1988年.
・〜月経周期の長さ〜多価不飽和脂肪酸摂取量多いほど短い傾向、Medical Tribune、22頁、2006年7月27日号.
・南山堂 医学大事典 縮刷版(1954年1月第1版発行、1975年1月第5版).
・島袋充生:脂肪毒性、日本医師会雑誌、第136巻・特別号(1)、メタボリックシンドローム up to date、S100-S103頁.
・浅原実郎:アンチエイジング医学の基礎と臨床、日本抗加齢医学会専門医・指導士認定委員会、株式会社メジカルビュー社、2004年第1版第1刷発行(2006年第1版第8刷).
・船橋徹、野口緑著、松澤佑次監修:メタボリックシンドローム 脂肪細胞のひみつとつきあい方(メディカルトリビューン社、2007年).
・2008年度版 看護学入門 第2巻 食生活と栄養・薬物と看護、平成19年11月20日、第1版第1刷発行、株式会社メヂカルフレンド社.
・やさしく学ぶための輸液・栄養の第一歩、日本静脈経腸栄養学会 NSTプロジェクト実行委員会編集、大塚製薬株式会社企画、2001年5月第1版.
・伊藤裕:腸!いい話、朝日新聞出版、2011年11月30日第1刷発行.
・Willett WC, et al: Relation of meat, fat, and fiber intake to the risk
of colon cancer in a prospective study among women. N Engl j Med 1990; 323: 1662-72.
|トップページ|脂質と血栓の関係|ミニ医学知識|生化学の知識|医学の話題|小児科疾患|生命の不思議|リンク集|



