





肝臓での糖代謝
【ポイント】
肝臓は、ブドウ糖を、糖新生やグリコーゲン分解により、肝静脈を経て、全身(脳や、骨格筋など)へ供給している。
肝臓は、空腹時などには、糖新生により血中(肝静脈血)にブドウ糖を供給し、食事摂取時には、門脈血からブドウ糖を取り込み、肝静脈血へのブドウ糖供給を停止し、血糖値を一定に維持する。
肝臓は、食後に、門脈血中のブドウ糖を取り込むが、動脈中のブドウ糖は、あまり取り込まない(門脈シグナル)。肝臓は、血液(動脈血や門脈血)中にブドウ糖が増加すると、糖新生を抑制し、ブトウ糖を取り込むが、肝臓の糖取り込み速度は、門脈血のブドウ糖の方が、動脈中のブドウ糖より、4倍程、速い。
正常人では、肝臓の糖新生は、低濃度のインスリンでも抑制される。他方、肝臓のブドウ糖取り込みは、インスリンの作用に依存しないGLUT2により行われる為、インスリン濃度で差が生じにくい。
糖尿病では、空腹時には、糖新生抑制作用のあるインスリンが不足する為、肝臓での糖新生が亢進する(空腹時高血糖になる)。糖尿病では、食後には、肝臓での糖新生が抑制されず、糖放出の抑制が低下し、また、肝臓の(門脈血からの)糖取り込みや、筋肉や脂肪組織の糖取り込みが低下する(食後高血糖になる)。
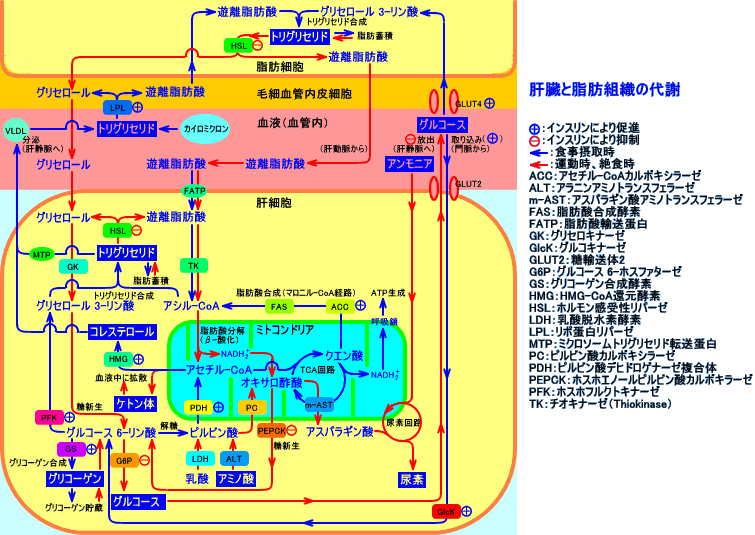
肝臓は、食事摂取時に、トリグリセリドをVLDLとして、分泌し、脂肪組織に輸送して、貯蔵させる。そして、肝臓は、絶食時や運動時に、脂肪組織から放出される、遊離脂肪酸やグリセロールを、トリグリセドやグルコースに変換し、再び、脂肪組織に、戻す。
肝臓は、脂肪酸をβ-酸化し、脂肪酸のエネルギーからブドウ糖(グルコース)を生成し、また、ケトン体を生成し、他の組織で、代謝燃料として、利用することが出来るようにする。
肝臓(「肝」)は、アミノ酸代謝(AAAなど)や解毒(アンモニアなど)などにより、脳神経機能(自律神経系など)を調節する。
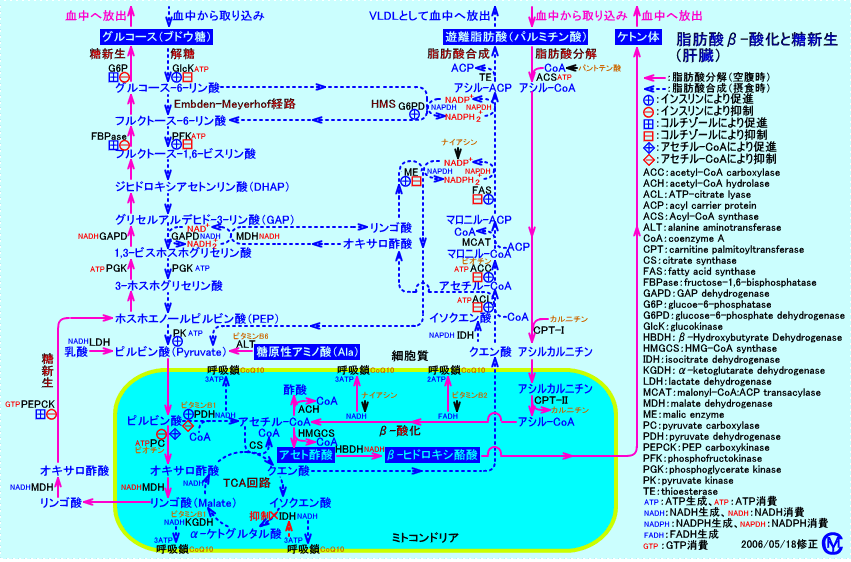
肝臓は、糖代謝(ブドウ糖の代謝)に於いて、重要な役割を果たしている。肝臓は、ブドウ糖の取り込み(門脈血から食事由来のブドウ糖を取り込む)も、ブドウ糖の放出(肝臓で糖新生されたブドウ糖や、グリコーゲンを分解して生成されたブドウ糖を放出する)をも行う特殊な臓器。肝臓は、特に、糖新生により、肝静脈を経て、全身(脳や、骨格筋など)へブドウ糖(グルコース)を供給している。
肝臓は、様々な代謝機能を果たしている。
肝臓は、脂質代謝では、脂肪酸合成や、トリグリセリド合成や、コレステロール合成など、重要な役割を果たしている。ほとんど全ての細胞でコレステロール合成が行われるが、コレステロール合成の約50%は、肝臓で行われる。肝臓に存在するコレステロールは、20%が食事由来(カイロミクロン由来)のコレステロールで、80%が肝臓で生成されたコレステロールと言われる。
ここでは、主に、肝臓での糖代謝に関して、糖尿病との関連に於いて、言及する。
糖尿病では、インスリンの作用不足の為、肝臓での糖新生が抑制されない為、空腹時高血糖になる。
糖尿病では、食後に、肝臓での、糖新生が抑制されず、糖放出の抑制が低下し、また、門脈血からのブドウ糖取り込みが低下し、食後高血糖になる。
肝臓は、空腹時に、糖新生によりブドウ糖を血中(肝静脈)に、糖放出する。肝臓は、食後に、門脈血中のブドウ糖を取り込むが、動脈中のブドウ糖は、あまり取り込まない。
食事で摂取され、消化管から門脈血中に入ったグルコース(ブドウ糖)は、肝臓で取り込まれ、残りが、肝静脈から血中に入り、動脈血中に入ったグルコースは、主に、骨格筋のGLUT4により取り込まれる(骨格筋が、約70%の血糖を取り込む)。
生体(肝臓)は、血糖に関しては、上昇させること(糖新生)を、低下させること(グリコーゲン合成や糖取り込み)を優先している。糖尿病では、インスリンと言う、血糖の上昇(糖新生)にブレーキをかける(抑制する)因子がなくなり、肝臓からの糖放出が、続くようになる。
肝臓の機能が悪い為、易疲労感があっても、血液の肝機能検査(AST、ALT値など)に、異常を認めないことがある。例えば、超音波検査で脂肪肝と検出された症例であっても、血液の肝機能検査値で、AST(GOT)、ALT(GPT)値が高値を示すのは、約半数までと言われる。

1.肝臓は、血液中への糖(グルコース)放出を調節し、血糖値を調節する
心筋など多くの組織は、定常状態で、遊離脂肪酸(FFA)を主なエネルギー源としているが、脳は、ブドウ糖(グルコース)をエネルギー源としている。
肝臓は、空腹時や睡眠中や絶食時などには、糖新生により、血液中にブドウ糖(グルコース)を供給し、低血糖に陥らないようにしている。
血糖の消費量は、脳が多く、血糖の約半分は、脳で消費される。続いて、肝臓、筋肉、赤血球、腎髄質の消費が多い。しかし、脂肪組織の消費は、約5%に過ぎない。
肝臓は、食事の後には、インスリンの作用で、血液中への糖(グルコース)放出を抑制し、血糖値の上昇を抑制する。また、肝臓は、空腹時(絶食時)には、貯蔵しているグリコーゲンの分解や、糖新生により、血液中への糖放出を促進する。
糖新生に必要なNADH2+は、脂肪酸のβ-酸化により供給される。肝臓は、β-酸化系の酵素活性が多く発現していて、糖新生、ケトン体の産生などが行われる。肝臓では、脂肪酸をβ-酸化し、脂肪酸のエネルギーをグルコースとして蓄積し、また、ケトン体を生成し、他の組織で、代謝燃料として、利用することが出来るようにする。
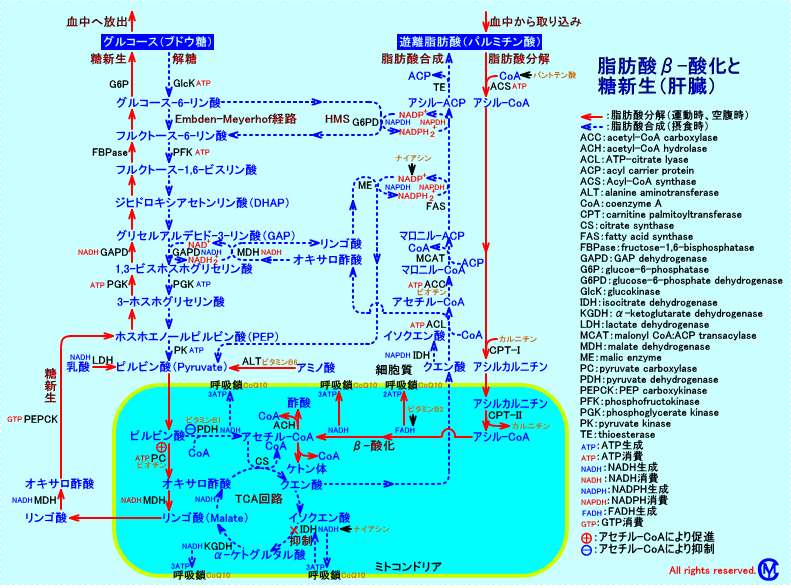
肝細胞では、絶食時(血糖低下時)に、血中に増加した遊離脂肪酸(脂肪組織のトリグリセリドがHSLにより分解され生成される)を取り込み、ミトコンドリア内でβ-酸化する。
肝細胞が遊離脂肪酸をβ-酸化すると、ミトコンドリア内にNADH2+やFADH2が増加し、呼吸鎖(電子伝達系)の燃焼容量が満杯になり、TCA回路は、作動しなくなる。遊離脂肪酸のβ-酸化により、アセチル-CoAが増加すると、ケトン体が生成されるが、ケトン体のアセト酢酸は、NADH2+により還元され、β-ヒドロキシ酪酸となって、放出される。また、遊離脂肪酸のβ-酸化により、ミトコンドリア内に増加したNADH2+は、ミトコンドリア外にリンゴ酸として還元等量が輸送され、糖新生が、行われる。
このように、肝臓では、遊離脂肪酸のβ-酸化に伴い、糖新生、ケトン体の産生が増加するが、TCA回路は作動しない(TCA回路の代謝によっては、NADH2+は、電子伝達系に供給されない)。
肝臓は、空腹時や夜間や絶食時などには、糖新生により肝静脈から血中にブドウ糖を供給し、食事を摂取して門脈を経てブドウ糖が流入すると、門脈血からブドウ糖を取り込み、肝静脈へのブドウ糖供給を停止する。
夜間から早朝までの空腹期間にも、脳などの代謝に必要なグルコースが、肝臓から、血液中に放出され、供給される。この肝臓から放出されるグルコースの約75%は、グリコーゲン分解により供給され、約25%は、糖新生(骨格筋由来のアラニンなどのアミノ酸や、脂肪組織由来のグリセロールなどが、原料になる)により供給される。
インスリンは、グリコーゲン分解や糖新生を抑制する。糖尿病で、基礎インスリン分泌が低下すると、肝臓でのグリコーゲン分解や糖新生が亢進し、空腹時に著明な高血糖を来たす。糖尿病では、肝臓のグリコーゲン貯蔵量は、正常人の半分程度と言われる。糖尿病では、糖新生が亢進する為、朝食前血糖値など、空腹時血糖値が、上昇する。糖新生を抑制するには、グリコーゲン分解を抑制するより、多くのインスリンを必要とする。
インスリンは、肝細胞に於いて、脂肪酸(アシル-CoA)や、グルコース 6-リン酸の合成を促進させ、トリグリセリド(中性脂肪)や、コレステロール生成を促進し、VLDLの合成・分泌を増加させる。
肝臓での糖新生を抑制し、肝臓からの糖放出を抑制することは、糖尿病の治療において、重要。
脂質(特に、動物性脂肪など、飽和脂肪酸を多く含むトリグリセリド)や、蛋白質の摂取を控えると、肝臓からの糖放出が抑制される(肝細胞へのトリグリセリドの蓄積が減り、グリコーゲンとして、貯蔵されるブドウ糖が、増加する)。
肝臓は、絶食時などには、トリグリセリドの合成を止め、糖新生へ代謝を変換する。sirtuin 1は、PGC1-αのアセチル基を除去し、PGC1-αと結合し、糖新生(糖産生)を開始させる。絶食時には、筋肉で、乳酸やアラニンが生成され、血中を肝臓に輸送され、それぞれ、コリ回路やグルコース-アラニン回路により、ピルビン酸やグルコースとに変換される(注1)。
肝臓内で、グルコースの解糖で生成されるピルビン酸は、グルコースが十分に存在する時には、ピルビン酸脱水素酵素(PDH)によりアセチル-CoAに変換され、脂質(脂肪酸やコレステロール)が生成されたり、アミノ酸(アラニン、セリン、グリシンなど)が生成されたり、TCA回路で代謝される。
ピルビン酸は、グルコースが十分に存在しない時には、ピルビン酸カルボキシラーゼ(PC)によりオキサロ酢酸に変換され、糖新生が行われたり、アミノ酸(アスパラギン酸)が生成される。
糖尿病では、肝臓での乳酸産生の亢進、骨格筋での乳酸利用の低下、肝臓での糖新生系の亢進(肝臓でのアラニン取り込みの増加)、ミトコンドリア内でのピルビン酸脱水素酵素活性の低下(ピルビン酸や乳酸がアセチル-CoAに変換されない)などのため、血中に、乳酸が増加しやすい。ピルビン酸脱水素酵素(Pyruvate dehydrogenase)は、インスリンにより活性化されるが、インスリンが欠乏した糖尿病では、この酵素の活性が抑制され、糖新生の原料となるピルビン酸が、増加し易い。ピルビン酸は、sirtuin 1を活性化させ(増加させ)、sirtuin 1によりアセチル基を除去されたPGC1-αが、(ピルビン酸から)グルコースへの糖新生を、促進させる。インスリンが欠乏した糖尿病では、血糖値が高いにも拘らず、肝臓において糖新生が行われている(インスリンによる糖新生の抑制が行われない)。
糖尿病での食後高血糖は、肝臓での糖取り込み率の低下が原因で、空腹時高血糖は、肝臓での糖新生の亢進が原因。
肝臓は、インスリンの作用に依存しないGLUT2により、ブドウ糖を取り込む。
正常人の肝臓での糖新生は、食後、低濃度のインスリンでも、高濃度のインスリンと同様に、抑制される。しかし、正常人の肝臓でのブドウ糖取り込みは、食後、高濃度のインスリンでないと、増加しない。正常人では、食後、肝臓の糖新生は、低濃度のインスリンでも抑制され、また、肝臓のブドウ糖取り込みは、インスリン濃度で差が生じにくい。
(インスリンが不足した)糖尿病患者の肝臓は、糖新生が亢進しているが、食後、肝臓でのブドウ糖取り込みは、行われている。
糖尿病患者の肝臓は、食後、高濃度のインスリンを(門脈に)注入しても、門脈血からのブドウ糖取り込みは、低下している。
糖尿病では、UDP-グルコースを経るグリコーゲン合成は低下するが、三炭糖を経て糖新生経路を経るグリコーゲン合成は、低下しない(インスリン不足により、グルコースが、グルコキナーゼにより、グルコース 6-リン酸に変換されず、UDP-グルコースを経るグリコーゲン合成は、低下する。三炭糖が、糖新生経路に入り、グルコース 6-リン酸に変換され行われるグリコーゲン合成は、低下しない)。
脂肪肝のように、肝臓に脂肪(トリグリセリド)が蓄積すると、グリコーゲン貯蔵や糖新生が阻害され、肝臓の血中へのグルコース供給能が低下する(易疲労性が高まったり、脳のスタミナが低下したりする)。
脂肪肝になると、食後の肝臓での糖取り込み率が低下し、食後高血糖になる。また、脂肪肝になると、夜間の肝臓での糖放出率が増加する(糖新生が増加する)。
従って、脂肪肝では、過剰な糖の流入→インスリン分泌の増加→肝臓でのトリグリセリド合成の促進→脂肪肝→食後高血糖や夜間(空腹時)高血糖→インスリン分泌の増加、と言う、悪循環が形成される。
2.門脈シグナル
肝臓は、門脈(消化管から吸収されたブドウ糖が流入する)血中のブドウ糖(外因性グルコース)は、積極的に取り込む。しかし、肝臓は、肝動脈血中のブドウ糖(血液中を循環している内因性グルコース)をは、僅かしか、取り込まない(なお、筋肉など、肝臓以外の組織は、門脈から注入されたグルコースよりも、末梢循環を流れて来たグルコースを、多く取り込む)。
肝臓は、門脈から流入するグルコース(消化管で吸収され門脈を流れて来た外因性グルコース)を積極的に取り込むが、肝動脈から流入するグルコース’末梢循環から肝動脈を経て再循環して来た内因性グルコース)をは、僅かしか、取り込まない。
この現象は、門脈シグナルと呼ばれる。
門脈シグナルは、門脈内にグルコースセンサーが存在し、そのグルコースセンサーが感知したグルコース濃度上昇の情報が、迷走神経求心路を介して、中枢(脳)に伝達され、遠心路を介して、肝臓に伝わり、肝臓の何らかの律速酵素(グルコキナーゼ)を活性化し、グルコースの取り込みが増加すると考えられている。
なお、インスリンは、迷走神経刺激によっても、分泌される。

3.肝臓は、尿素回路により、有毒なアンモニアを処理し、尿素に変換する
肉食など、高蛋白食は、窒素代謝で生成されるアンモニアを、尿素回路で処理する為に、肝臓に負担が掛かる。
アスパラギン酸などのアミノ酸は、尿素回路の代謝を促進させ、肝機能を高めると、考えられる。また、クエン酸、リンゴ酸などの有機酸は、TCA回路の代謝を促進させ、尿素回路に必要なATP供給を高めると、考えられる。
肝臓の機能が悪くなると、副腎や、消化管にも、負担が掛かる。
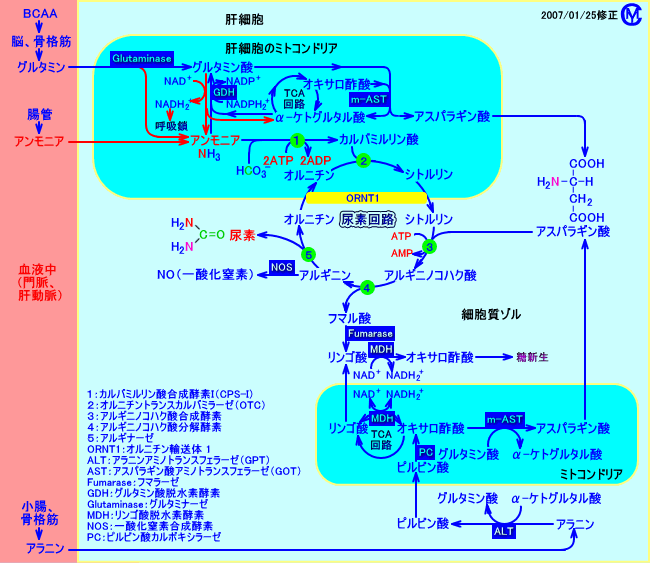
なお、動物性蛋白質(肉、魚など)を多く摂取すると、尿中のリン酸塩、硫酸塩が増加し、尿細管での酸塩基平衡調節に負担が掛かり、尿が酸性化する(カルシウム再吸収が抑制され、尿中カルシウムが増加し、尿路結石のリスクも高まる)。
4.肝臓は、トリグリセリドやコレステロールを合成し、末梢組織に、供給する
肝臓は、余剰に摂取した炭水化物を、トリグリセリドやコレステロールに変換させ、VLDLとして、血液中に放出し、末梢組織に供給する。
a).脂肪細胞に貯蔵するトリグリセリドの合成
トリグリセリドの合成の用いられるグリセロール 3-リン酸(α-グリセロリン酸)は、グルコースの代謝(解糖)により生成される。
トリグリセリドの合成に用いられる脂肪酸(アシル-CoA)は、グルコースの代謝(アセチル-CoA)により生成された脂肪酸か、食事由来の脂肪酸が用いられる。
摂取カロリーが過剰で、肝臓でのトリグリセリドの合成が過剰で、高脂血症になり、末梢組織に運搬出来ないと、トリグリセリドが、肝臓の肝細胞に蓄積し、脂肪肝になる。
肥満や糖尿病は、脂肪肝になり易い。
脂肪肝になっても、自覚症状が現れないことも多いが、脂肪肝になった肝細胞では、グリコーゲン貯蔵や糖新生が阻害され、肝臓の血中へのグルコース供給能が低下し、易疲労性、全身倦怠感、食欲不振の原因となることもある。
脂肪肝になった肝細胞では、ミトコンドリア内での脂肪酸のβ-酸化に伴い、活性酸素が発生し、過酸化脂質が生成され、肝炎、肝硬変、肝癌に至ることもある。
血液中にブトウ糖(血糖)が不足する(絶食時や運動時)と、脂肪組織のトリグリセリドが分解され、遊離脂肪酸が放出される。遊離脂肪酸は、末梢組織(心筋、骨格筋、腎臓、脳など)で取り込まれ、エネルギー源となったり、あるいは、肝臓で取り込まれ、トリグリセリドに再合成される。肝臓は、遊離脂肪酸の20〜40%を取り込む。る。
脂肪細胞では、トリグリセリド(中性脂肪)が、HSL(インスリンが活性を抑制する)により分解され、遊離脂肪酸と、グリセロールが、血中に放出される。
肝臓では、遊離脂肪酸(FFA)を取り込んで、アシル-CoAとし、グルコースやグリセロールから生成されるグリセロール 3-リン酸にエステル結合させ、トリグリセリドが再合成される。
グリセロール 3-リン酸は、血中から取り込まれたグルコースの代謝からも生成される。
グリセロール 3-リン酸は、糖新生でグルコースに変換されたり(絶食時など)、アシル-CoAを結合してトリグリセリドに変換されたり(食事摂取時)する。
(絶食時の)肝細胞内では、グルコースからの解糖と、グリセロールからの糖新生が、同時に、行われる。
. 多量にグリセロールが存在すると(肝細胞に多量のグリセロールが注入されると:5
mm bolus of glycerol)、グルコース(40 mm)のリン酸化(phosphorylation)や解糖(glycolysis)が抑制され、(糖新生により、)ATPが枯渇し、グリセロール 3-リン酸が蓄積する。
他方で、グルコース(10 mm glucose)が存在しても、グリセロールかの糖新生は、抑制されない。
肝臓では、グリコーゲン合成と、脂肪酸合成とが、平行して(同時に)、行われる可能性がある。
脂肪組織では、運動時などに、HSLにより、トリグリセリドが分解され、遊離脂肪酸と、グリセロールが生成される。
遊離脂肪酸は、筋肉に取り込まれ、エネルギー源となったり、肝臓に取り込まれ、(食事摂取時に、)グリセロール 3-リン酸にエステル結合させ、トリグリセリドに、再合成し、VLDLとして分泌され、脂肪組織に、戻される。
グリセロールは、脂肪組織(白色脂肪細胞)では、GK(グリセロキナーゼ:glycerokinase)の活性が低い為、GKが存在する肝臓に取り込まれ、グリセロール 3-リン酸を経て、糖新生に利用され、ブドウ糖(グルコース)として、脂肪組織に、戻される。
このように、肝臓は、食事摂取時に、トリグリセリドをVLDLとして、分泌し、脂肪組織に輸送して、貯蔵させる。そして、肝臓は、絶食時や運動時に、脂肪組織から放出される、遊離脂肪酸やグリセロールを、トリグリセドやグルコースに変換し、再び、脂肪組織に、戻す。
超音波検査で脂肪肝と検出された症例であっても、血液の肝機能検査値で、AST(GOT)、ALT(GPT)値が高値を示すのは、約半数の症例に過ぎないと言われる。
脂肪肝など、肝臓の機能が悪い為、全身倦怠感、易疲労感があっても、血液の肝機能検査(AST、ALT値など)に、異常を認めないことがある。
b).末梢組織が必要とするコレステロールの生成
肝臓では、アセチル-CoA(グルコースの解糖などにより生成される)から、HMG-CoA(3-ヒドロキシ-3-メチルグルタリル-CoA:-hydroxy-3-methylglutaryl-coenzyme
A)を経て、HMG-CoA還元酵素(HMG-CoA reductase))により、メバロン酸(mevalonate)が合成される。
メバロン酸からは、内因性コレステロールが合成され、VLDLとして、血中に放出される。
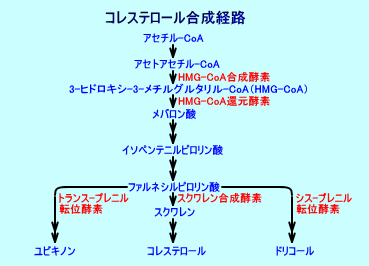
コレステロールの合成は、ほとんど全ての細胞でが行われる、コレステロール合成の約50%は、肝臓で行われる。
コレステロールを多く含む食餌を摂取すると、肝臓で行われるコレステロール合成は抑制され、内因性コレステロール量は減少する、完全に抑制されることはない。
コレステロールは、ステロイドホルモン(副腎皮質ホルモン)の産生に必要。ステロイド核は、コレステロールから合成される。
なお、肝臓以外でも、すべての組織の細胞は、コレステロールを合成し得るが、その量は、少ない。
5.肝臓は、毒性物質(毒素)を、処理する
毒性物質(毒素)は、血管系やリンパ系により輸送され、肝臓や腎臓で代謝・濾過され、便や尿や汗として、排泄される。
肝臓は、全身の細胞に糖(グルコース)、蛋白質(アルブミンなど血漿蛋白、アミノ酸、血液凝固因子)、脂質(トリグリセリド、コレステロール)を供給する。他方で、肝臓は、全身の細胞から出た老廃物(窒素代謝で生じるアンモニアなど)を回収し、無毒化させたり、リサイクルする。
脂肪組織の脂肪や、肝臓の脂肪には、毒性物質(毒素)が、蓄積し易い。
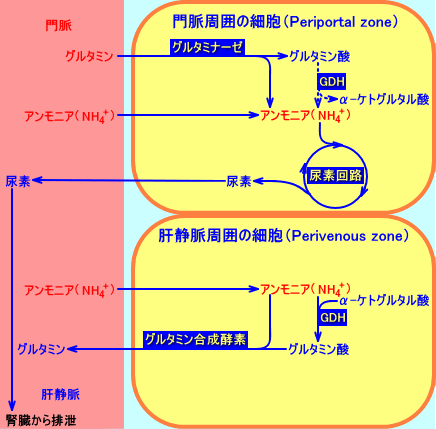
6.肝臓でのグルタミンの代謝
肝臓は、循環血中(門脈血中)より、グルタミンとアンモニアを、取り込む。
門脈周囲の細胞(periportal cells)内で、グルタミンは、グルタミナーゼにより分解され、その結果生成されるアンモニアは、循環血中を肝臓に流れて来たアンモニアと共に、尿素回路で、尿素に変換される。
循環血中を肝臓に流れて来たアンモニアは、門脈周囲の細胞(periportal cells)内で処理されないと、肝静脈周囲の細胞(perivenous cells)で、グルタミン合成酵素により、グルタミンに変換される。
従って、肝臓は、アンモニアを取り込んで、尿素を排泄するが、(門脈血中と肝静脈血中で)グルタミンの濃度は、ほとんど変化しない。
7.ケトン体
肝臓では、遊離脂肪酸のβ-酸化により、アセチル-CoAが増加すると、ケトン体が生成される。
ケトン体は、血中を輸送され、他の肝外組織(脳や心筋など)で、エネルギー源となる。
ケトン体は、肝外組織で、サクシニル-CoA : 3-ケト酸CoAトランスフェラーゼ(SCOT)により、アセトアセチル-CoAに活性化される。アセトアセチル-CoAは、ミトコンドリアで、アセトアセチル-CoAチオラーゼ(T2)により、アセチル-CoAに変換され、TCA回路で利用され、呼吸鎖でATP(エネルギー)が生成される。
SCOTは、肝臓以外の組織、特に、心筋、脳、末梢血リンパ球、線維芽細胞(繊維芽細胞)に発現している。
SCOT欠損症やT2欠損症では、ケトン体が、肝外組織に取り込まれないので、ケトン体が血中に増加する(ケトーシス)。
SCOT欠損症は、間歇期には、持続性ケトーシスが存在しても、無症状(ミトコンドリア内、チオラーゼがT2の他にも存在するので、T2欠損症では、持続性ケトーシスを来たさない)。
SCOT欠損症は、感染や飢餓を契機に、強いケトーシス発作(ケトアシドーシス発作)を来たし、最悪の場合、死亡する。
SCOT欠損症は、ケトーシス発作時、嘔吐、筋緊張低下、意識障害、多呼吸(代謝性アシドーシスの呼吸で代償する為)などが見られる。
SCOT欠損症は、アセトン血性嘔吐症(自家中毒)に類似したケトーシス発作を起こす。
SCOT欠損症は、2歳以下に発症する。アセトン血性嘔吐症は、殆どは、2歳以降に発症する。
SCOT欠損症では、発作時、通常、低血糖は、見られない。高アンモニア血症、高乳酸血症も、見られない。尿酸は、高値を示す。
SCOT欠損症は、飢餓や感染などの発作時には、ブドウ糖輸液を行い、脂肪酸のβ-酸化によるケトン体の生成(ケトーシス)を抑制する。
8.肝臓の類洞
肝臓では、門脈と動脈を流れて来た血液が、網目状の類洞(sinusoid:体循環の毛細血管に相当する)で混合され、肝静脈に流れ出る。肝臓は、門脈の終末(終末門脈枝)と、肝動脈の終末が、類洞(sinusoid)を形成し、中心静脈(終末肝静脈)に流入する。
体循環の毛細血管系のように、類洞は、肝臓の微小循環系として、肝細胞との種々の物質交換(栄養素、アンモニアなど)に、関与している。
毛細血管の内径は、ほほ一様で、約10μmなのに対して、類洞の内径は、不規則で、5〜30μm(時に、40〜50μm)。
肝臓の類洞壁を構成する肝類洞壁細胞には、クッパー細胞、類洞内皮細胞、肝星細胞、Pit細胞の4種類が存在する。

1).類洞内皮細胞
類洞内皮細胞(sinusoidal endothelial cell)は、類洞に沿って扁平な形状で存在する細胞で、類洞壁を形成する。類洞内皮細胞は、一般の毛細血管内皮細胞と異なり、基底膜を有していない。類洞内皮細胞と肝細胞の間には、Disse腔(Disse space)が存在する。Disse腔では、類洞を流れて来た血液と、肝細胞との間で、種々の物質交換が行われる。肝硬変になると、類洞内皮細胞下に基底膜が出現し、類洞内皮細胞小孔が減少する。
2).クッパー細胞
クッパー細胞(Kupffer's cell)は、類洞腔内に、類洞内皮細胞に接着して、存在する。クッパー細胞は、骨髄由来で肝臓に遊走したマクロファージで、貪食能や抗原提示細胞機能を有する。クッペル星細胞とも呼ばれた。
3).伊東細胞
伊東細胞(Itoh cell)は、群馬大学の伊東俊夫教授により発見された。
伊東細胞は、一般には、肝星細胞(hepatic stellate cell)と呼ばれる。伊東細胞は、脂肪貯蔵細胞(fat-storing
cell)、リポサイトとも呼ばれる。伊東細胞は、Disse腔(類洞外の、類洞内皮細胞と肝細胞との間の空間)に、存在する。
伊東細胞は、肝線維芽細胞系の細胞であり、筋線維芽細胞へ分化し、膠原線維(コラーゲン)を産生する。
伊東細胞は、肝線維化、更に、肝硬変を来たす。
伊東細胞は、ビタミンA貯蔵細胞でもあり、ビタミンAを、レチノールエステルとして、貯蔵する(ビタミンAを含んだ脂肪滴を含んでいる)。
伊東細胞は、類洞の血流調節にも、関与している。
伊東細胞(肝星細胞)には、脂溶性のビタミンAを含んだ脂肪滴が、多量に貯蔵されている。
慢性肝疾患では、ビタミンAを含んだ脂肪滴が消失し、それに伴ない、肝星細胞が活性化し、肝線維化が進展し、肝細胞癌が発生する。
食品中のビタミンA(レチノール)は、小腸で吸収され、門脈を経て、肝臓に輸送され、肝臓の肝細胞で、レチナールを経て、レチノイン酸に変換される。レチノイン酸は、核内に移行し、レチノイン酸受容体(レチノイン酸レセプター:RAR)に結合する。レチノイン酸受容体の機能を消失したマウスでは、細胞内の代謝が変化し、ミトコンドリアでの脂肪酸β-酸化(脂肪酸分解)に関与する、CPTII、VLCAD、LCAD、HCDの酵素発現量が低下する。他方で、ペルオキシソームでの脂肪酸β-酸化の律速酵素である、AOXやBFEの酵素発現量が増加する。このように、レチノイン酸受容体の機能を消失したマウスでは、ミトコンドリアでの長鎖脂肪酸や中鎖脂肪酸(MCT)のβ-酸化が減少し、ペルオキシソームでの極長鎖脂肪酸のβ-酸化が増加する。
4).ピット細胞
ピット細胞(Pit cell)は、NK細胞と考えられ、類洞腔内に、存在する。
9.その他
・肝臓は、脂質代謝に於いて、中心的な役割を果たしている。
肝臓は、トリグリセリド(中性脂肪)を合成し、VLDLとして、血液中に分泌する。
肝臓で行われるトリグリセリド合成に必要な脂肪酸(アシル-CoA)は、以下の2種類によって生成された脂肪酸である。
1).肝細胞内で、グルコースが解糖され、アセチル-CoAを経て、脂肪酸合成により生成された脂肪酸。
2).循環血液中から肝細胞内に取り込まれた遊離脂肪酸。遊離脂肪酸は、脂肪細胞内でホルモン感受性リパーゼ(HSL)によりトリグリセリドが分解され生成されるか、毛細血管壁のLPLにより血中のカイロミクロンやVLDL内のトリグリセリドが分解され生成される。
飢餓状態(絶食時)、脂肪含量が多い食事を摂取している時、糖尿病などの場合は、2)のように、循環血液中から取り込まれた遊離脂肪酸が、肝臓内や、分泌されるVLDL内のトリグリセリドの脂肪酸を構成する。
炭水化物が多い食事、特に、ショ糖(砂糖)の含量が多い食事は、肝臓からのVLDLの分泌を、促進させる。アルコール摂取や、高インスリン血症も、肝臓からのVLDLの分泌を、促進させる。
・血清中では、遊離脂肪酸の70〜87%は、アルブミンに結合している。
血清中(血液中)の遊離脂肪酸の量は、脂肪組織での中性脂肪(トリグリセリド)の分解による遊離脂肪酸の放出と、肝臓での遊離脂肪酸の取り込みによって、調節されている。
遊離脂肪酸は、血液中のグルコース量(ブドウ糖濃度=血糖値)が不足した状況(飢餓時、絶食時、断食時など)では、グルコースに変わるエネルギー源として、利用される。
遊離脂肪酸は、血液中のグルコース量が不足した状況(飢餓時など)では、骨格筋、心臓、腎臓では、エネルギー源として利用され、また、肝臓では、糖新生のエネルギー源となる(脂肪酸のβ-酸化が行われる)。
正常男性(基礎代謝1,800kcal/日)が、24時間、絶食すると、脂肪組織で、中性脂肪が、ホルモン感受性リパーゼ(HSL)により、加水分解され、100gの遊離脂肪酸が生成される。その遊離脂肪酸の内、肝臓は、40g(20〜40%)を取り込み、脂肪酸分解(β-酸化)により生成するエネルギー(NADH2+など)を、糖新生に利用する。肝臓は、食事摂取を開始すると、血液中から取り込んだ遊離脂肪酸と、グルコースとから、中性脂肪を再合成し、リポ蛋白(VLDL)として、血中に放出する。
・ヒトと同様なビタミンC合成不能ラットを用いた実験結果では、食餌中にビタミンEを添加しないと、アルコールを自由に飲ませた群は、飲料水を飲ませた群に比して、血清中の過酸化脂質が増加するが、肝臓の過酸化脂質量は変わらない。
食餌中のビタミンC量を増やしても、アルコールを自由に飲ませた群では、血清中の過酸化脂質量は増加する:ビタミンCによる、ビタミンE再生作用は、認められなかった。
・慢性肝炎から、肝硬変になるに従い、亜鉛が欠乏する。亜鉛が欠乏する理由は、慢性肝疾患の患者では、食事摂取量が少なくなったり。摂取する食事の品数が少なくなったり、摂取する食物の種類が画一的になり、栄養状態が偏り、摂取する亜鉛の量が減少している為と言われる。
亜鉛が欠乏すると、尿素回路の機能が低下したり、細胞膜の脂質酸化(lipid
peroxidation)が亢進し、細胞膜が不安定化して細胞障害や肝線維増生などが起こる。
・慢性肝疾患(アルコール性肝障害、脂肪肝など)では、ビタミン類や、ミネラル(亜鉛、カルシウムなど)が欠乏しないよう補給する為、野菜や海藻類も多く摂取する。
必須脂肪酸や、ビタミンB6(ピリドキシン)や、ビタミンB5(パントテン酸)が欠乏すると、脂肪肝が発症し易くなる。
・於血で見られる手掌紅斑は、手掌全体が、赤くなることが多い。肝障害(肝硬変など)で見られる手掌紅斑は、手掌の中心部を除いて、辺縁部(母指球と小指球)や指が、赤くなる(紅潮・発赤する)。
・ゴマ(胡麻)に含まれるゴマリグナン(セサミンなど)は、肝臓の活性酸素を減少させ、肝機能を上昇させると言う。
ゴマリグナンは、肝臓で、β-酸化を促進させる(β-酸化系酵素と同じ働きをする)。
ゴマに含まれるセサミン(ゴマリグナン)は、肝臓で、ミトコンドリアとペルオキシゾームのβ-酸化系酵素の活性を,、増加させる。セサミンは、PPAR-αを活性化させ、脂肪酸分解を促進する。セサミンは、脂肪酸合成をは抑制する:セサミンは、SREBP-1を抑制し、脂肪酸合成酵素、ATP-クエン酸リアーゼ、ピルビン酸キナーゼの活性を抑制し、アセチル-CoAカルボシキラーゼ(ACC)の活性も軽度抑制する。
その結果、熱産生が増加するので、ゴマは、冷え性(冷え症)の治療に良い。



・肝臓は、アルブミンを、1日10〜15g生成する。
・1948年に米国のパテック等が、肝硬変の患者に、1日3,500kcalの高蛋白・高カロリー・高ビタミン食を与えて、劇的な改善が得られたと報告した為、肝硬変に、高蛋白食が推奨された時期もあった。しかし、パテック等が治療した肝硬変患者は、多く(80%)が、食事を十分に摂取しないで常用飲酒していたアルコール性肝硬変であった。
ウイルス性肝硬変の患者では、高蛋白食は、却って、肝性脳症を悪化させる(高蛋白食は、尿素回路でのアンモニア処理の為、肝臓に負担をかけたり、腸内細菌によるアンモニア産生を増加させるおそれが考えられる)。
・肝硬変になると、血液中に芳香族アミノ酸(AAA)やメチオニンが増加し、BCAAが低下する。
・肝臓は、脂肪酸分解(β-酸化)に際しては、ケトン体を生成し、また、アルコール分解に際しては、酢酸を生成し、血液中に放出する。
・日本では、非アルコール性脂肪性肝疾患の患者(飲酒しないのに脂肪肝になった患者)が1,000万人程度存在し、その10%程度は炎症を伴ない肝硬変に進行する。
非アルコール性脂肪性肝疾患(非アルコール性脂肪肝)は、50歳代前半に多く、脂肪肝炎は50歳代後半に多い。
脂肪肝では、肝臓に中性脂肪(トリグリセリド)が蓄積する。非アルコール性脂肪肝(NASH:ナッシュ)から、脂肪肝炎が発生するには、脂質の過酸化(過酸化脂質)が関与している。
非アルコール性脂肪肝で脂肪肝炎を発生した患者の3〜4割の患者は、肝臓に過剰に鉄が蓄積して、炎症、繊維化、発癌を増悪化させている。
・中医学で言う「肝」(中医学の五臓の一つ)は、自律神経系及び情動の一部を結合した存在(西洋医学で言えば中枢神経系の機能の一部を総括した概念)。「肝」は、精神機能の安定を司る。
「肝」の失調は、消化吸収機能である脾臓や、呼吸機能である肺臓の働きを大きく損なう。
肝臓は、自律神経の支配を受けている(自律神経により糖新生などが影響を受ける)。
「肝」:主疏排、蔵血、主筋=情緒系中枢・自律神経系・筋肉運動系の調節、視力に関与など(肝臓は物質を生成したり解毒することで脳神経系の機能を安定化させる)。
五行:肝=木、心=火、脾=土、肺=金、腎=水
肝=情緒・自律神経系+造血系+運動機能+視力+肝機能の一部+α
心=心臓血管系+α
脾=消化吸収系+α
肺=呼吸器系+皮膚+α
腎=泌尿生殖系+骨格+内分泌+呼吸+α(老年期に衰える機能は腎関係)
五行の相生関係:木(肝)→火(心)→土(脾)→金(肺)→水(腎)
五行の相生関係(相互関係)からすると、「肝」が機能する(木を生む)には、腎(副腎=水)の力が必要(木=肝は火=心を生む)。「心}(しん:精神を意味する「こころ」ではない)のエネルギーは、「肝」が供給する(心筋に必要な脂肪酸やグルコースは、肝臓が生成し供給する)。
五行の相克関係からすると、「肝」(木)の機能は、「脾」(土)の機能を抑制する(脾の機能は肝が抑制する)。「腎」の機能は、「心」の機能を抑制する(心の機能は腎が抑制する)。
「肝」=情緒、自律神経、造血系、運動機能、視力、肝機能の一部
漢方薬の「抑肝散」は、脳の神経伝達物質のグルタミン酸(Glu)の上昇を抑制し、セロトニン受容体(5-HT2A受容体)を抑制し、BPSD(認知症に由来して生じる攻撃性、幻覚などの周辺症状)を改善すると言う。
喜驚傷心、怒傷肝、思傷脾、悲憂傷肺、恐傷腎
「肺」で取り入れられた清気は、「腎」で納気される(補腎納気)
気管支喘息を五行論的に捉える:「肺」は「清気」(外界の酸素)を取り入れる。取り入れられた「清気」は、「腎」に納められる。息を吸うのが吐くより苦しい場合、「腎」が「清気」を納める作用(納気作用)に問題があることがあり、「腎」に対する治療をすると、効果的なことがある(気管支喘息が改善される)。「肺」にエネルギーを供給するのは消化吸収機能(免疫機構?)を司る「脾」。「脾」の不調は喘息発作の引き金となる。「肝」の「脾」に対する抑制作用(相克作用)が過剰な場合(ストレスで消火器症状が起こり易い)は、「脾」の機能不全が起こり、「肺」へエネルギーが十分に供給されないことになる。
・肝臓の糖代謝は、膵臓から分泌されるインスリンやグルカゴン、副腎などから分泌されるカテコールアミンなど内分泌系(ホルモン)によって調節される。
肝臓の糖代謝は、肝自律神経系によっても調節される。肝交感神経は、グリコーゲン分解酵素を活性化させ、グリコーゲン合成酵素を抑制し、グルコースの肝臓から血中への放出を促進し、血糖を上昇させる。肝副交感神経は、肝臓のグリコーゲン合成酵素を活性化させ、グルコースの肝臓から血中への放出を抑制し、血糖を低下させる。
(肝臓の)交感神経は、肝臓の繊維化に関与する。交感神経遮断や、α受容体遮断薬の投与は、肝繊維化を抑制する。
肝星細胞(伊東細胞)は、自身からノルアドレナリンを分泌し、肝星細胞の細胞膜のアドレナリン作動性受容体を直接刺激すると言われる。
注1:コリ回路(Cori cycle)で、乳酸2分子から、グルコース1分子を生成するには、ピルビン酸からの糖新生の為に、ATP6分子が必要:グルコースが乳酸にまで分解される際には、ATP2分子しか生成されないので、必要なATPは、ミトコンドリアの呼吸鎖で生成される。
グルコース-アラニン回路で、アラニン1分子からから、グルコース1分子を生成するには、ピルビン酸からの糖新生の為にATP6分子が必要で、かつ、アラニンから放出されるアミノ窒素を尿素回路で尿素として処理する為に、ATP2分子が必要で、合計、ATP8分子が消費される(グルコース1gを糖新生で得る為には、タンパク質2gを分解する必要がある)。
参考文献
・ハーパー・生化学(原著14版、三浦義彰監訳、丸善株式会社、 1975年).
・ヴォート生化学(東京化学同人、2003年、第4刷).
・鈴木紘一、他:ホートン生化学 第3版(東京化学同人、2005年、第3刷).
・新糖尿病治療薬開発の方向示唆 糖産生調節蛋白質が標的に Medical Tribune 2005年5月12日号、47頁.
・弘世貴久:糖尿病食事療法における脂質・蛋白制限の考え方 日本醫事新報 No.4214(2005年1月29日)、88-89頁.
・河盛隆造:今日の血糖コントロールの考え方 日本醫事新報 No.4193(2004年9月4日)、1-5頁.
・菊池方利:肝における糖調節機構について 日本醫事新報 No.4184(2004年7月3日)、21-30頁.
・門脇孝:糖尿病の病態生理 日本医師会雑誌 特別号 糖尿病診療マニュアル Vol.130,
No.8, S32-34, 2003年.
・田嶼尚子:インスリンと糖代謝 日本医師会雑誌 第124巻・第1号、IS-13〜IS-16、2000年.
・斉藤康:インスリンと脂質代謝 日本医師会雑誌 第124巻・第3号、IS-17〜IS-20、2000年.
・松島照彦、他:遊離脂肪酸(FFA) 臨床雑誌 内科 Vol.61, No.6(特大号)、61:1142頁、1988年.
・松田幸次郎、他訳:医科生理学展望(原著6版、丸善株式会社 1975年).
・John W Phillips et al: Implications of the simultaneous occurrence of hepatic
glycolysis from glucose and gluconeogenesis from glycerol Eur. J. Biochem. 269, 792-797 (2002).
・泉井亮、金田研司:カラー図解 人体の正常構造と機能 IV肝・胆・脾、日本医事新報社、2003年.
・田川邦夫:からだの働きからみる代謝の栄養学 タカラバイオ株式会社(2003年).
・深尾敏幸:サクシニル-CoA : 3-ケト酸CoAトランスフェラーゼ欠損症−アセトン血性嘔吐症との鑑別を− 小児科 Vol.38
No.4、321-326、1997年.
・肝疾患診療マニュアル、日本医師会雑誌 特別号、Vol.122 No.8、1999年.
・中嶋俊彰:よくわかる最新医学 新版肝臓病、平成16年(主婦の友社).
・汐田剛史:質疑応答 レチノイドの肝癌への作用、日本医事新報 No.4298(2006年9月9日)、90-91頁.
・黒澤美枝子:質疑応答 肝臓支配の自律神経、日本医事新報 No.4309(2006年11月25日)、91-92頁.
・下田哲也:平凡社新書194 漢方の診察室、株式会社平凡社、2003年初版第1刷発行.
|トップページ|脂質と血栓の関係|ミニ医学知識|生化学の知識|医学の話題|小児科疾患|生命の不思議|リンク集|



 1.肝臓は、血液中への糖(グルコース)放出を調節し、血糖値を調節する
1.肝臓は、血液中への糖(グルコース)放出を調節し、血糖値を調節する 3.肝臓は、尿素回路により、有毒なアンモニアを処理し、尿素に変換する
3.肝臓は、尿素回路により、有毒なアンモニアを処理し、尿素に変換する
 ・肝臓は、アルブミンを、1日10〜15g生成する。
・肝臓は、アルブミンを、1日10〜15g生成する。