



糖脂質
グルコース(ブドウ糖)、ガラクトース(Gal)、マンノース、N-アセチルグルコサミン(GlcNAc)、N-アセチルガラクトサミン(GalNAc)、フコース、キシロース、シアル酸などの糖は、複雑に連なって、糖鎖を形成する。
糖鎖は、蛋白や糖脂質と結合して、糖蛋白質や、糖脂質となり、結合した蛋白質や脂質を安定化させたり、蛋白質のタグ(荷札)として細胞間での情報伝達に、重要な役割を果たしたり、プロテオグリカンとして水分を結合させ組織を保護する。
1.ガングリオシド
ガングリオシド(ganglioside)は、シアル基や硫酸基を有する糖脂質。ガングリオシドは、神経系の修復(神経細胞の突起伸長)、細胞の分化・増殖、種々の物質(毒素、ウイルスなど)に対するレセプター機能、ホスホキナーゼ活性化などの整理活性を有する。
ガングリオシドは、神経栄養因子作用、神経突起伸張作用、神経組織修復作用がある。
ガングリオシドは、脳の灰白質に最も多く含まれているが、赤血球、肝臓、腎臓、消化管粘膜などにも、含まれている。
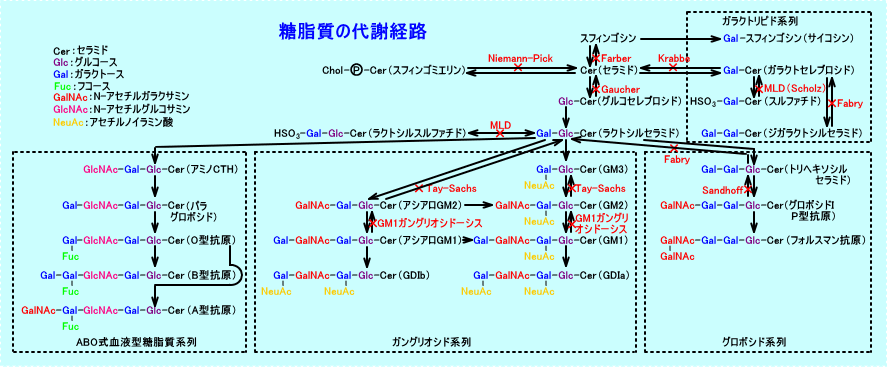
ガングリオシドのGM1は、神経系、特に、脳灰白質を中心に広く存在している。
ガングリオシドのGM1は、細胞内小器官のリソソーム内の酸性加水分解酵素(GM1βガラクトシダーゼ、GM2β-Nアセチルガラクトアミニナーゼ)により、糖鎖が順次分解され、GM1→GM2→GM3となる。
GM1:Galβ1-3GalNAcβ1-4[NeuAcα2-3]Galβ1-4Glcβ1-1Cer
GM2:GalNAcβ1-4[NeuAcα2-3]Galβ1-4Glcβ1-1Cer
GM3:NeuAcα2-3Galβ1-4Glcβ1-1Cer
なお、Gal:ガラクトース、GalNAc:N-アセチルガラクトサミン、NeuAc:N-アセチルノイラミン酸、Glc:グルコース、Cer:セラミド(Ceramide:セレブロシド)の略。
ガングリオシドは、スフィンゴ糖脂質の代謝で、ラクトシルセラミド(Galβ1-4Glcβ1-1Cer)から、合成されるが、ABO式血液型物質や、グロボシドも、ラクトシルセラミドから、合成される。パラグロボシドは、ガラクトース(Gal)と、N-アセチルグルコサミン(GlcNAc)からなる、タイプ1の基幹領域(Galβ1→3GlcNAc)を、含んでいて、フコース(Fuc)が結合すると、O型抗原(H抗原)になる。
セラミド(Ceramide:Cer)は、セレブロシド(cerebroside)とも呼ばれる。セラミドは、スフィンゴシン(sphingosine)と脂肪酸とが結合した脂質。必須脂肪酸が欠乏すると、O-アシルセラミドのアシル部位(脂肪酸部位)が、リノール酸エステルから、オレイン酸エステルに、変化し、セラミドの皮膚バリアー機能も、減少してしまう。
グルコセレブロシド(glucocerebroside:Glc-Cer)は、グルコシルセラミド(glucosylceramide)とも呼ばれる。グルコセレブロシドは、セラミドに、グルコース(ブドウ糖:Glc)が結合している。グルコセレブロシドは、赤血球の主な脂質成分であるgloboside Iやlactosylceramide、白血球に含まれるlactosylceramideを構成している。これらの血球膜糖脂質が、脾臓のリソソームで分解される際に、多量のグルコセレブロシド(Glc-Cer)が産生される。網内系細胞(脾臓や肝臓やリンパ節)のリソソームで産生されたグルコセレブロシド(Glc-Cer)は、βグルコセレブロシダーゼにより分解される。
脳に存在するセレブロシド(cerebroside)は、セラミド(Cer)に、ガラクトース(Gal)が結合した、ガラクトシルセラミド(galactosylceramide)であり、ガラクトセレブロシド(galactocerebroside)とも呼ばれる。
ガングリオシドのGM3(注1)は、脂肪組織の主要なスフィンゴ糖脂質である。TNF-αは、GM3合成酵素(SAT-I)遺伝子の発現を亢進させ、脂肪組織でのGM3発現を増加させ、インスリンのシグナル伝達(IRS-1)を抑制し、インスリン抵抗性を来たすと言う。
ゴーシェ病(Gaucher disease)では、リソソーム(ライソゾーム)内に局在するβグルコセレブロシダーゼ(β-glucocerebrosidase)が、先天的に欠損し、グルコシルセラミド(グルコセレプロシド)が、網内系に蓄積し、肝臓や脾臓が、腫大する。βグルコセレブロシダーゼは、β-グルコシダーゼ(β-glucosidase)、グルコシルセラミドβ-グルコシダーゼ(glucosylceramide β-glucosidase:Glc-Cer-β-glucosidase)とも呼ばれる。
ゴーシェ病のI型(成人型)は、小児期に発症して、慢性に経過して、成人期に至ることが多い。主症状は、脾腫、肝腫、貧血、血小板減少、長管骨や脊椎の骨粗しょう症や骨変形、皮膚の色素沈着などが見られる。
ゴーシェ病のII型(小児型)は、生後6カ月未満に発症し、2歳前に死亡することが多い。主症状は、脾腫、肝腫、血小板減少に加え、初期から多彩な神経症状(痙攣など)を呈する。骨症状は、明らかでないこともある。ゴーシェ病のII型で神経症状が現れる成因は不明だが、グルコシルスフィンゴシン(glucosylsphingosine)など神経毒性を有する物質の関与が推測されている。
欧米では、ゴーシェ病のI型が多く、日本では、ゴーシェ病のII型が多い。
Fabry病で蓄積するトリヘキソシルセラミド(trihexosylceramide)は、別名、グロボトリオシルセラミド(globotriosylceramide:Gb3)、グロボトリアオシルセラミド(globotriaosylceramaide)、セラミドトリヘキソシド(ceramide
trihexoside:CTH)、とも呼ばれる。
Gb3は、細胞表面のベロ毒素受容体でもある。
Krabbe病(クラッベ病)は、セレブロシダーゼ欠損(ガラクトセレブロシド
β-ガラクトシダーゼ欠損)が病因。
Krabbe病は、グロボイド細胞性脳白質異栄養症(グロボイド細胞ロイコジストロフィー:Globoid
Cell Leukodystrophy:GLD)とも呼ばれ、常染色体劣性遺伝をする。
Krabbe病は、乳児期前半(生後3〜6カ月)に発症し、中枢神経症状(被刺激性の亢進、四肢緊張の亢進)が見られ、精神運動発達が遅れる。
Krabbe病は、欠損酵素の基質であるガラクトセレブロシド(ガラクトセラミド)の多量の蓄積はなく、リゾ体のサイコシン(ガラクトシルスフィンゴシン)が、正常の100倍以上、蓄積する。ガラクトセレブロシド(ガラクトセラミド)は、ミエリンの構成脂質であるが、ミエリンに蓄積するのでなく、マクロファージ由来のグロボイド細胞を形成させる。サイコシンは、ミエリン形成細胞のオリゴデンドログリア細胞の機能を障害する。サイコシン(ガラクトシルスフィンゴシン)は、強い細胞毒性があり、サイコシンの大脳含量と、脱髄程度とには、相関が見られる。
2.セラミド代謝とアトピー性皮膚炎
表皮細胞で産生されたセラミドなどの脂質は、角質最下層において細胞外に排出され、角質細胞間脂質となり、皮膚のバリア機能や水分保持機能(保湿機能)を担う。
特に、セラミドは、角質細胞間脂質の約50%を占めていて、その代謝は、皮膚のバリア機能や保湿機能の維持に重要とされる。細胞間脂質は、セラミド(約50%)の他、コレステロールエステル(15%)、(遊離)コレステロール(5%)、脂肪酸(20%)から、構成されている。
アトピー性皮膚炎の患者の皮膚は、健常者の皮膚に比して、皮疹部のみならず、無疹部(アトピー性皮膚炎を起こしていない部分の皮膚)でも、セラミド含量(角質重量当たりのセラミド量)は、有意に低下している。
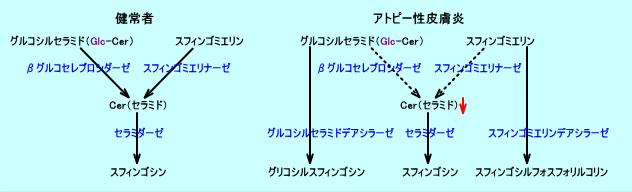
セラミドの生成には、まず、表皮細胞(有棘層や顆粒層)で、セリン(アミノ酸)とパルミトイル-CoA(活性脂肪酸)から、ケトスフィンガニンが生成され、その後、種々の酵素で代謝され、セラミドが生成される。生成されたセラミドは、グルコシルセラミド、又は、スフィンゴミエリンとして、表皮細胞から、細胞外に排出され、角質細胞間脂質となる。
セラミドは、角質細胞間で、グルコシルセラミド、又は、スフィンゴミエリンから、再度、生成されたり、分解され、角質細胞間脂質のセラミド量は、一定に保たれる。
セラミド(セレブロシド)の生成は、βグルコセレブロシダーゼ(β-グルコシダーゼ)による経路(グルコシルセラミドを、セラミドとグルコースとに分解する)と、スフィンゴミエリナーゼによる経路(スフィンゴミエリンを、セラミドとフォスフォリルコリンとに分解する)と、二つの経路により、行われる。
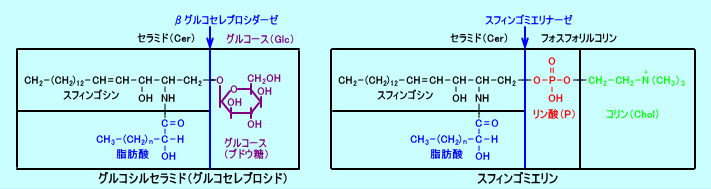
皮膚のバリア機能に重要なセラミド1(アシルセラミド)の生成は、アシルグルコシルセラミドから、βグルコセレブロシダーゼによる経路で、行われる。
セラミドの分解は、セラミドがセラミダーゼにより行われ、スフィンゴシンと遊離脂肪酸が、生じる。
アトピー性皮膚炎の患者では、セラミド含量(角質重量当たりのセラミド量)は、有意に低下している。
アトピー性皮膚炎の患者では、皮膚の角層(角質層)のβグルコセレブロシダーゼや、スフィンゴミエリナーゼや、セラミダーゼの活性は、正常である(健常者と差がない)。
アトピー性皮膚炎の患者では、スフィンゴミエリンを分解する酵素(スフィンゴミエリン水解酵素)の活性は、異常に高い:スフィンゴミエリン水解酵素の活性は、健常者に比して、皮疹部では27倍高く、また、無疹部でも7倍高い。なお、スフィンゴミエリン水解酵素の活性は、接触(性)皮膚炎患者では、高くないので、アトピー性皮膚炎の患者で、スフィンゴミエリン水解酵素の活性が高いことは、炎症が原因ではない。
アトピー性皮膚炎の患者の皮膚では、健常者に比して、スフィンゴミエリン水解酵素である、スフィンゴミエリンデアシラーゼ(スフィンゴミエリンを、スフィンゴシルフォスフォリルコリンと遊離脂肪酸とに分解する)の酵素活性が、高い。スフィンゴミエリンデアシラーゼ(スフィンゴミエリンデアシレース)の活性が高くなり、スフィンゴミエリナーゼの活性と競合すると、スフィンゴミエリンから、スフィンゴミエリナーゼによりセラミドが生成されず、スフィンゴミエリンデアシラーゼによりスフィンゴシルフォスフォリルコリン(スフィンゴシルホスフォリルコリン)が生成される。
スフィンゴシルフォスフォリルコリンは、炎症誘発因子であり、培養ヒト表皮細胞に、プロスタグランジン(PG)を産生させたり、細胞接着因子を発現させる。スフィンゴシルフォスフォリルコリン(スフィンゴシルホスフォリルコリン)は、スフィンゴミエリンのアシル基(活性脂肪酸)が、外れた物質。スフィンゴシルフォスフォリルコリンは、水分含量が、少ない。
しかし、皮膚のバリア機能に重要なセラミド1(アシルセラミド)の生成は、アシルグルコシルセラミドから、βグルコセレブロシダーゼによる経路で、行われ、スフィンゴミエリンから、生成されるのではない。
そこで、グルコシルセラミドデアシラーゼ(グルコシルセラミドを、グルコシルスフィンゴシンと遊離脂肪酸とに分解する未知の酵素)の酵素活性を測定すると、アトピー性皮膚炎の患者の皮膚では、健常者に比して、皮疹部、無疹部共に、高い。また、アトピー性皮膚炎の患者の皮膚では、グルコシルセラミドデアシラーゼにより生成されるグルコシルスフィンゴシンが、健常者に比して、皮疹部、無疹部共に、増加している。
このように、アトピー性皮膚炎の患者の皮膚では、グルコシルセラミドデアシラーゼの活性が高くなり、βグルコセレブロシダーゼの活性が競合し、アシルグルコシルセラミドからグルコシルセラミドデアシラーゼによりグルコシルスフィンゴシンが生成され、βグルコセレブロシダーゼによるアシルセラミドの生成が減少していると考えられている(注2)。
3.カンピロバクター感染症とギラン・バレー症候群
カンピロバクター腸炎(Campylobacter jejuni)後、ギラン・バレー症候群(Guillan-Barre syndrome:GBS)を発症することがある。
Campylobacter jejuniのリポオリゴ糖(LOS)と、GM1ガングリオシドの末端4糖の糖鎖構造(Galβ1-3GalNAcβ1-4[NeuAcα2-3]Galβ1-)が、完全に一致する:GM1、GM1b、GD1a、GalNAc-GD1a、GD3、GT1a、GQ1b(注3)に、分子相同性がある。カンピロバクター腸炎では、GM1に対する抗体(IgG抗GM1抗体)が産生され、自己抗体として、脊髄前根の神経細胞膜のGM1に結合し、マクロファージにより、障害され、ギラン・バレー症候群を来たす。カンピロバクター腸炎後、ギラン・バレー症候群を来たした症例では、IgG抗GM1抗体の他、IgG抗GD1a抗体、IgG抗GalNAc-GD1a抗体、IgG抗GD1b抗体、IgG抗GQ1b抗体など、他のガングリオシドに対する抗体も、検出される。IgG抗GM1抗体、IgG抗GD1a抗体は、四肢脱力を、IgG抗GQ1b抗体は、顔面神経麻痺、外眼筋麻痺、球麻痺、運動失調、意識障害を来たす。
ギラン・バレー症候群の発症に関連する先行感染の病原体は、Campylobacter jejuniが32%、Mycoplasma pneumoniaeが5%、Cytomegalovirusが3%、Haemophilus influenzae(インフルエンザ菌)が3%、Epstein-Barr virus(EBV)が1%、と言われる。
Campylobacter jejuni以外にも、ガングリオシドに分子相同性のある微生物が知られている。
インフルエンザ菌(Haemophilus influenzae):GM1、GT1a
サイトメガロウイルス(Cytomegalovirus):GM2
肺炎マイコプラズマ(Mycoplasma pneumoniae):Galactocerebroside(GalCer)
これらの微生物に感染した後(先行感染の後)、ギラン・バレー症候群を合併する恐れがある。
ギラン・バレー症候群は、カンピロバクター腸炎による下痢症を発症後、1〜3週間後に、発症する。ギラン・バレー症候群の神経症状を発症した時点で、約4分の1の患者の便から、Campylobacter jejuniが検出される。我が国で、ギラン・バレー症候群の患者から分離されるCampylobacter jejuniは、血清型がPenner19血清型のことが多いが、他に、2型血清型、4型血清型が分離されることもある。
カンピロバクター腸炎に罹患後には、ギラン・バレー症候群以外に、反応性関節炎、Reiter症候群(反応性関節炎、結膜炎、尿道炎、発疹)、結節性紅斑、溶血性貧血、腎炎などを合併することがある。
なお、Campylobacter は、日本語では、「カンピロバクター」と発音されるが、「キャンピロバクター」と発音された時期もある。
4.ガングリオシドは、感染防御に関与する
ガングリオシドは、細菌やウイルスが、宿主の粘膜上皮細胞に結合する際の受容体(レセプター)と似た糖鎖構造をしている。
母乳には、ガングリオシドが含まれている。
母乳に含まれるガングリオシドは、主に、GM3、GD3だが、GM1も微量含まれている。
母乳に含まれるガングリオシドは、細菌やウイルスや、細菌毒素が、乳児(宿主)の口腔、咽頭、消化管などの粘膜上皮細胞に結合するのを、阻害する作用がある。
GM3、GD3、GM1は、毒素性大腸菌が、腸上皮細胞に付着することを、阻害する作用がある。GM3、GM1は、ラクトシルセラミド(Galβ1-4Glcβ1-1Cer)や、シアル酸から、構成されている。しかし、ラクトシルセラミドやシアル酸には、GM3、GM1のような、毒素性大腸菌の腸上皮細胞への付着を阻害する作用は、見られない。
糖鎖末端のシアル酸は、低pHで、分解され易い。しかし、pH3〜5(哺乳時の乳児胃内pH)でも、GM3、GD3は安定している。pH3〜5でも、GM3は約80〜90%、GD3は約50〜90%、(シアル酸構造が)保持される。
GM3は、インフルエンザウイルスや、ヘリコバクター・ピロリと、特異的に結合する(リセプター類似物質として、感染防御に関与する)。GD3は、破傷風毒素と、特異的に結合する。
注1:GM3は、山川民夫博士により、赤血球膜に存在する糖脂質ヘマトシドとして、発見された。
GM3は、TPA(フォルボールエステル)同様に、ヒト白血病細胞株HL60を、単球・マクロファージ系へと、分化誘導する。
注2:βグルコセレブロシダーゼが先天的に欠損して、低下して、グルコシルセラミド(グルコセレプロシド)が蓄積するゴーシェ病(Gaucher病)では、皮膚に色素沈着が見られる。ゴーシェ病では、セラミドの形成が低下して、皮膚のバリア機能や水分保持機能が低下している。ゴーシェ病でも、約30%のセラミドが存在している(70%のセラミドは、グルコシルセラミドからβグルコセレブロシダーゼにより生成され、30%のセラミドは、スフィンゴミエリンからスフィンゴミエリナーゼにより生成されると推察されている)。しかし、ゴーシェ病で、特に、アトピー性皮膚炎症状を呈するという記載はない。
アトピー性皮膚炎の患者は、βグルコセレブロシダーゼの活性が、グルコシルセラミドデアシラーゼの活性と競合し、βグルコセレブロシダーゼによるアシルセラミドの生成が減少し、アトピー性皮膚炎を発症すると言う説では、ゴーシェ病の患者で、βグルコセレブロシダーゼの活性が欠損し、セラミド含量が低下しているのに、アトピー性皮膚炎症状を呈さないことを、説明困難に、思われる。また、グルコシルセラミドデアシラーゼで生成されると言う、グルコシルスフィンゴシンには、神経毒性はあっても、皮膚炎を起こすのかも、疑問に思われる。
アシルセラミドの減少によるバリアー機能の低下より、むしろ、スフィンゴミエリンデアシラーゼ(スフィンゴミエリナーゼと競合する)の活性が高くなり、産生されるスフィンゴシルフォスフォリルコリンが、炎症を誘発し、プロスタグランジン(PG)の産生などを介して、アトピー性皮膚炎の独特の皮膚炎を起こすのかも知れない。
アトピー性皮膚炎は、βグルコセレブロシダーゼによる経路が障害され、アシルセラミド産生が減少することが発症の原因でなく、スフィンゴミエリナーゼによる経路が障害され、炎症を誘発するスフィンゴシルフォスフォリルコリンが生成されることの方が、発症に関与しているのかも知れない。
また、アトピー性皮膚炎では、何故、βグルコセレブロシダーゼの活性が正常なのに、アシルセラミドが減少して、グルコシルスフィンゴシンが増加するのかも、疑問に思われる。アシルセラミドを構成する脂肪酸の性状などに関する研究を期待したい。
アトピー性皮膚炎では、漢方的には、体内で処理されない毒素(濁毒)が、皮膚に溜まった為の炎症反応と考えられる。その皮膚に溜まった毒素を、血行を良くしたりして、排毒させると、アトピー性皮膚炎は、改善する。治療に用いていた、ステロイド剤も皮膚に蓄積している。アトピー性皮膚炎が改善する際、症例によっては、ステロイド剤の臭いのするネバネバした液が、皮膚から排泄され、黄色い膿が噴き出すことがあると言う。
食養や漢方薬で於血を改善すると、アトピー性皮膚炎は治ることがある。その際、急速な皮膚の新生(基底細胞の増殖)に伴ない、古い皮膚が剥脱し、皮膚の赤味が増したり、漏出液(ジクジク)が増加することがある。
糖類・糖分(砂糖など)の摂取は、アトピー性皮膚炎を悪化させる(中性脂肪が増加したり、血液が酸性化し、於血が悪化する)。
注3:ガングリオシドのGQ1bは、神経細胞の細胞外リン酸化反応を起こし、神経突起を伸張させる。
参考文献
・洲鎌盛一、他:Krabbe病脱髄因子サイコシンの毒性に対するガングリオシドの防御効果 日本小児科学会雑誌 97巻6号 1349-1353, 1993年.
・松尾義之:第3の分子生物学 日経サイエンス 16-55, 1993年4月号.
・上田英雄、他:内科学(第四版、1987年、朝倉書店).
・鈴木明身、他:糖脂質 臨床医 第8巻・第9号 86-88, 1982年.
・石橋睦子、他:バリア病としてのアトピー性皮膚炎 日本医師会雑誌 第126巻・第1号 33-36,
2001年.
・小児症候群 小児内科臨時増刊 Vo.15, 1983年(東京医学社).
・大和田操:Gaucher病 小児内科 Vol.21 臨時増刊号(小児疾患診療のための病態生理)、241-245, 1989年.
・藤田晃三:カンピロバクター腸炎 小児科臨床 52: 467-40, 1999年.
・乳汁に含まれるガングリオシド スポット小児科医 No.25, 1997年(社団法人日本小児科学会広報委員会).
・母乳に含まれるガングリオシドの機能 スポット小児科医 No.26, 1997年(社団法人日本小児科学会広報委員会).
・小鷹昌明、他:ギラン・バレー症候群 わかりやすい免疫疾患 日本医師会雑誌 特別号(1) 生涯教育シリーズ−67、S275-S280、2005年.
・西岡清:アトピー性皮膚炎の診方・考え方 小児アレルギー −基礎と臨床− 平成10年(協和発酵).
・岡田耕造:漢方薬だけで「治せる!」難治性アトピー性皮膚炎、東京図書出版会(2003年).
|トップページ|脂質と血栓の関係|ミニ医学知識|生化学の知識|医学の話題|小児科疾患|生命の不思議|リンク集|




