



ミトコンドリアの輸送系
ミトコンドリア外膜には、ポリン(porin)と言う穴構造(外膜チャネル)が存在し、大きさ10kD以下の分子は、自由拡散で通過する。従って、膜間スペース(膜間腔)の代謝産物やイオンの濃度は、ミトコンドリア外(細胞質ゾル)と同等になっている。
しかし、ミトコンドリア内膜は、ミトコンドリア外膜に比して、蛋白含量が高く、ミトコンドリア内膜を通過出来るのは、水(H2O)、酸素(O2)、二酸化炭素(CO2)、アンモニア(NH3)に限られ、NADH2+、ATP、ADP、Ca2+、ピルビン酸、オキサロ酢酸、リン酸(Pi)などの通過は、ミトコンドリア内膜の種々の輸送系( )により、制御されている。
イオンや代謝物質は、ミトコンドリア内膜を通過出来ないので、ミトコンドリア内(マトリックス)と、ミトコンドリア外(細胞質ゾル)との間には、イオン濃度勾配が、生じる。
ミトコンドリアは、小胞体と同様に、細胞質ゾルのCa2+濃度(カルシウムイオン濃度)を、安定させる。
Ca2+(カルシウムイオン)は、ミトコンドリアでのエネルギー産生(ATP産生)を調節する。
ミトコンドリア内Ca2+濃度(Cam)が減少すると、アポトーシスが起こる。
アポトーシスを惹起するPTPの開口(induction)は、Ca2+に依存する。その理由は、Bernardiの実験結果から、PTPの開口は、膜電位(the proton electrochemical gradient:⊿μH+)により制御されていて、Ca2+(Camの増加)が、ミトコンドリア内で、膜電位(⊿μH+)を変化させて、PTPの開口(induction)を引き起こすためと、考えられる。
1.NADH2+の輸送系
解糖で、ミトコンドリア外(細胞質ゾル)に生じるNADH2+は、ミトコンドリア内膜を通過出来ない(注1)。
NADH2+のエネルギー(還元当量の電子)を、ミトコンドリア外から、ミトコンドリア内に輸送する輸送系(NADHシャトル)としては、リンゴ酸-アスパラギン酸シャトル、グリセロリン酸シャトル、リンゴ酸-クエン酸シャトルが存在する。
肝臓で主に作用するNADHシャトルは、リンゴ酸-アスパラギン酸シャトル(MA shuttle)。
1).リンゴ酸-アスパラギン酸シャトル
リンゴ酸-アスパラギン酸シャトル(malate-aspartate shuttle)は、ミトコンドリア外のNADH2+のエネルギーを、ミトコンドリア内膜を経て、ミトコンドリア内(マトリックス)へ転送する為の仕組みで、哺乳類で発達している。
リンゴ酸-アスパラギン酸シャトルは、肝臓、心臓、腎臓などの臓器の細胞で、働いている。

リンゴ酸-アスパラギン酸シャトルでは、まず、ミトコンドリア外(細胞質ゾル)のオキサロ酢酸が、リンゴ酸脱水素酵素(リンゴ酸デヒドロゲナーゼ、MDH:malate dehydrogenase)により、リンゴ酸に変換される。その際、NADH2+がNAD+に酸化され、リンゴ酸にNADH2+から電子(H)が移動する。
リンゴ酸は、ミトコンドリア内膜のリンゴ酸-α-ケトグルタル酸輸送体を通過して、ミトコンドリア内(マトリックス)に輸送される。
ミトコンドリ内に輸送されたリンゴ酸は、MDHにより、オキサロ酢酸に戻され、その際、リンゴ酸に移動した電子(H)により、NAD+が還元され、ミトコンドリア内に、NADH2+が生成される。
このようにして、ミトコンドリア外のNADH2+の電子(H)の還元当量が、ミトコンドリア外(細胞質ゾル)から、ミトコンドリア内膜を経て、ミトコンドリア内に転送され、電子伝達系で利用可能となる:NADH2+その物が、ミトコンドリア内膜を通過するのではない。
AST(GOT)は、リンゴ酸-アスパラギン酸シャトル(malate-aspartate shuttle、malate-aspartate carrier system)を作動させるのに必要な酵素。
リンゴ酸-アスパラギン酸シャトルは、肝臓、心臓、腎臓などの臓器の細胞で機能し、解糖で生じたNADH2+のエネルギーを、ミトコンドリ外(細胞質ゾル)からミトコンドリア内に輸送する役割をする。
リンゴ酸-アスパラギン酸シャトルを利用して、NADH2+をミトコンドリア内に輸送した場合、一つのNADH2+当り、3ケのATPが生成されると言う。
リンゴ酸-アスパラギン酸シャトルの反応は、運動時など、ATP生成を要する際には、下図の→方向に働き、ミトコンドリア外のNADH還元当量を、ミトコンドリア内に輸送し、電子伝達と酸化的リン酸化に使用し、ATPを生成することが出来る。
リンゴ酸-アスパラギン酸シャトルを、下図の→方向に働かせる駆動力は、陰性に荷電したマトリックスから、陰性荷電のアスパラギン酸を組みだす、グルタミン酸-アスパラギン酸輸送体(Asp- / H-Glu antiporter)によると言う。
また、リンゴ酸-アスパラギン酸シャトルを構成する、リンゴ酸輸送系の輸送(反応)は、可逆的(注2)なので、糖新生の際には、運動時とは逆に、下図の←方向に働き、ミトコンドリア内のNADH還元当量を、ミトコンドリア外に、輸送する。その際、同時に、糖新生に必要なオキサロ酢酸をも、ミトコンドリア内からミトコンドリア外に、輸送する(引き出す)。

リンゴ酸-アスパラギン酸シャトル(malate-aspartate shuttle)は、ミトコンドリア膜を直接通過出来ないNADH2+やNADに変わり、還元当量を、リンゴ酸として、輸送する。
NADH/NAD+比([NADH] / [NAD+] ratio)は、NADH2+とNAD+の濃度比([NADH] / [NAD+] ratio)。
TCA回路の代謝を調節する重要な因子は、TCA回路の基質のアセチル-CoAとオキサロ酢酸、それと、生成されたNADH2+。
オキサロ酢酸は、リンゴ酸とは、次式の平衡関係にある。
K=[オキサロ酢酸][NADH]/[リンゴ酸][NAD+]
ここで、K=6.2×10-6。従って、[NADH] / [NAD+]=[リンゴ酸]/[オキサロ酢酸]×6.2×10-6。
典型的には、NADH/NAD+比([NADH] / [NAD+] ratio)は、ミトコンドリア内(マトリックス)では0.1(オキサロ酢酸/リンゴ酸比は、6.2×10-5:ミトコンドリア内では、リンゴ酸濃度が高い)、細胞質(cytoplasm)では、0.002(オキサロ酢酸/リンゴ酸比は3.1×10-3:細胞質ゾルでは、オキサロ酢酸濃度が高い)。
ミトコンドリア内では、NADH/NAD+比が0.1なので、オキサロ酢酸濃度がかなり低くない限り、ミトコンドリア内では、オキサロ酢酸は、リンゴ酸に還元される。細胞質では、NADH/NAD+比が0.002なので、細胞質では、リンゴ酸は、オキサロ酢酸に酸化される。
TCA回路では、リンゴ酸濃度は5mM以上だが、オキサロ酢酸の濃度は0.1mM以下と、低い。
細胞質内の[NADH] / [NAD+]比は、細胞質内の乳酸/ピルビン酸比(lactate/pyruvate ratio)を反映し、また、ミトコンドリア内の[NADH]
/ [NAD+]比は、β-ヒドロキシ酪酸/アセト酢酸比(β-hydroxybutyrate/acetoacetate
ratio)を反映する。
ピルビン酸カルボキシラーゼ欠損症(PC欠損症)では、ミトコンドリア内で、ピルビン酸から、オキサロ酢酸を生成出来ない。その為、PC欠損症では、細胞質内の乳酸/ピルビン酸比([NADH]
/ [NAD+]比)は、高値となり、また、ミトコンドリア内のβ-ヒドロキシ酪酸/アセト酢酸比([NADH]
/ [NAD+]比)は、低値になる。
このように、ピルビン酸カルボキシラーゼ(PC)により、オキサロ酢酸が産生されないと、リンゴ酸-アスパラギン酸シャトルが、上手く作動せず、細胞質内ではNADH2+が増加し、ミトコンドリア内ではNADH2+が減少する(paradoxical state)。
2).グリセロリン酸シャトル
グリセロリン酸シャトル(glycerol phosphate shuttle)は、ミトコンドリア内膜の膜間スペース側(膜間部側)に存在し、以下に述べるような3ステップの反応(仕組み)で、NADH2+を、ミトコンドリア内(マトリックス)に、輸送する。
1).細胞質ゾル(サイトゾル)のNADH2+の電子(H)は、グリセロール-3-リン酸デヒドロゲナーゼ(3-ホスホグリセロールデヒドロゲナーゼ)により、ジヒドロアセトンリン酸を還元し、NAD+と、グリセロール3-リン酸(α-グリセロリン酸)が、生成される。NAD+は、解糖系で、再利用される。
2).グリセロール3-リン酸の電子(H)は、ミトコンドリア内膜の膜間スペース側(膜間部側)で、フラボプロテインデヒドロゲナーゼにより、FAD+を還元し、FADH2+が、生成され、ジヒドロアセトンリン酸に戻る。
3).FADH2+は、ミトコンドリア内膜で、電子(H)を、電子伝達系に送り込み、FAD+に戻る。
グリセロリン酸シャトルは、筋肉などの臓器の細胞で、働いている(肝臓、心臓、腎臓以外の臓器の細胞で、働いている)。
グリセロリン酸シャトルを利用して、NADH2+をミトコンドリア内に輸送した場合、FADH2+がNADH2+の代わりになる為、一つのNADH2+当り、2ケのATPが生成されるに過ぎないと言う。
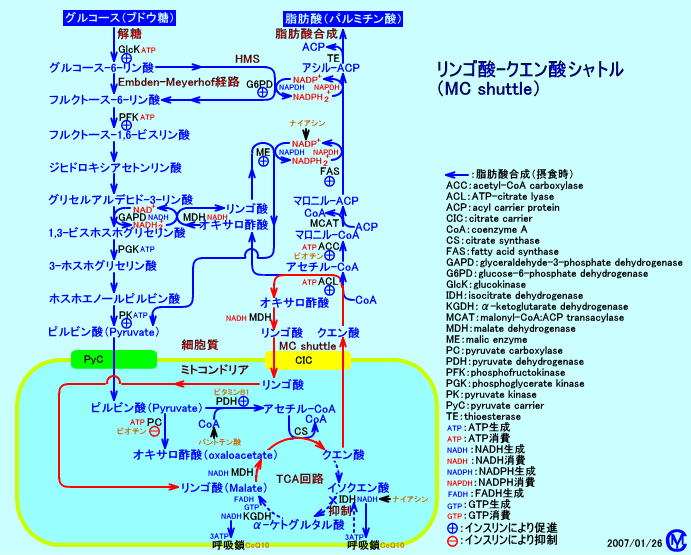
3).リンゴ酸-クエン酸シャトル
リンゴ酸-クエン酸シャトル(malate citrate shuttle:MC shuttle)では、クエン酸が、CIC(citrate carrier)によりミトコンドリア外に輸送され(脂肪酸合成に用いられる)、交換に、細胞質のリンゴ酸(NADH2+)がミトコンドリア内に輸送される。また、細胞質のピルビン酸が、PyC(pyruvate
carrier)を介して、ミトコンドリア内に輸送される。
CIC(citrate carrier)は、脂肪酸合成に際して、クエン酸輸送系として、ミトコンドリア内のクエン酸を細胞質に輸送する。クエン酸輸送系(クエン酸運搬系)は、ミトコンドリア内のクエン酸を細胞質に輸送し、交換に細胞質ゾルのリンゴ酸、ピルビン酸、リン(Pi)などの陰イオンをミトコンドリ内に輸送する。CIC(citrate
carrier)の前駆体(CIC precursor protein:pCIC)は、トリカルボン酸輸送体(tricarboxylate carrier)。
2.ATPの輸送系
ミトコンドリア内(マトリックス)で、酸化的リン酸化で生成されるATPは、ATP-ADP輸送体(ATP-ADPトランスロケータ)により、ミトコンドリア外(細胞質ゾル)に輸送され、交換に、ミトコンドリア外のADPが、ミトコンドリア内に輸送される。ATP-ADP輸送体は、ANT(adenine nucleotide translocase:アデニンヌクレオチドトランスロカーゼ)、AAA(ATP:ADP Antiporter)とも呼ばれる。ANTは、mPTPを構成していると、考えられている。
ATP-ADP輸送体は、30kDの同一アブユニットのニ量体で、二つの安定したコンホメーションを採る:一つのコンホメーションでは、ADP-ATP結合部位は、ミトコンドリア内側に向き(ミトコンドリア内膜側に位置して、マトリックス側に開く)、もう一つのコンホメーションでは、ADP-ATP結合部位は、ミトコンドリア外側に向く(ミトコンドリア外膜側に位置して、細胞質ゾル側に開く)。
ミトコンドリア内側に向いたコンホメーションのATP-ADP輸送体が、ミトコンドリア内のATPと結合すると、コンホメーションが変化して、ミトコンドリア外側に向いたコンホメーションのATP-ADP輸送体となり、ミトコンドリア外(細胞質ゾル)に、ATPを送り出して、変わりに、ADPと結合する。ミトコンドリア内のATPと結合したATP-ADP輸送体は、再び、コンホメーションが変化して、ミトコンドリア内側に向いたコンホメーションのATP-ADP輸送体となり、ミトコンドリア内に、ADPを輸送する。
ミトコンドリア内は、ATP(正味の電荷は-4)を送りだし、ADP(正味の電荷は-3)を取り込むので、差し引き、負電荷を一つ、送り出すが、その起電力は、プロトン濃度勾配が作る膜電位(
 )に依存している。
)に依存している。
ATPとADPの比([ATP] / [ADP] ratio)は、細胞質(cytoplasm)では、10:1~15:1で、ミトコンドリア内では、約1:30(ミトコンドリア内のATP/ADP比に関しては、約1.6、約2.1と言う報告もある)。
ミトコンドリア内のATP/ADP比([ATP] / [ADP] ratio)が大きいと、ATPが複合体IV
の サブユニットにアロステリックに結合し、酸化的リン酸化(呼吸) が抑制される(ADP濃度が高まる)。
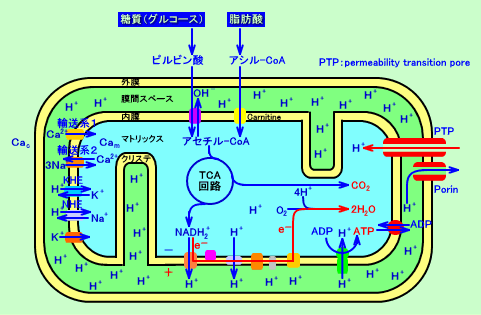
3.Ca2+の輸送系
ミトコンドリアには、Ca2+(カルシウムイオン)の輸送に関与する、輸送系1(流入系:influx)と、輸送系2(流出系:efflux)とが、存在する(注3)。輸送系1と輸送系2は、共役(coupling)している。
輸送系1(流入系)は、Ca2+-uniporterによる輸送により、膜間スペース(膜間腔)のCa2+を、ミトコンドリア内(マトリックス)に、流入させる。ミトコンドリア内膜の膜電位(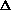
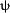 )が、マトリックス側が負(-)な為、陽イオンのCa2+を引き寄せ、Ca2+が流入する。輸送体1によるCa2+の流入(influx)は、呼吸鎖により、H+がミトコンドリア外に流出(efflux)することに、依存する。
)が、マトリックス側が負(-)な為、陽イオンのCa2+を引き寄せ、Ca2+が流入する。輸送体1によるCa2+の流入(influx)は、呼吸鎖により、H+がミトコンドリア外に流出(efflux)することに、依存する。
Ca2+-uniporterは、(ミトコンドリア)外のCa2+により活性化される(細胞質ゾルの[Ca2+]が低いと、Ca2+-uniporterは、活性が著しく低い)。
RaM(rapid uptake mode)は、細胞質ゾルの[Ca2+](Cac)が、生理的な濃度より高い(>400nM)時に作動し、細胞質ゾルの[Ca2+](Cac)が低下する(100~200nM)と、リセット(reset)される。
輸送系2(流出系)は、Na+-Ca2+交換輸送体(NCE:Na+/Ca2+ antiporter)による対向輸送により、マトリックスのCa2+を、膜間スペースに、流出させ(汲み出す)、交換に、3Na+を流入させる。輸送系2は、Na依存性にCaを流出(Efflux)させる経路(Na+-dependent pathway for Ca2+)。
輸送系2(NCE)以外に、Na+に依存しないで、Ca2+を流出させる経路(Na+-independent pathway for Ca2+ efflux:NICE)が、存在する。NICEは、恐らく、3H+の流入と交換に、Ca2+を流出させる、H+/Ca2+ antiporterと考えられている。
ミトコンドリアは、小胞体や、筋小胞体と同様に、細胞質ゾルのCa2+濃度を、安定させる(注4):細胞質ゾルの[Ca2+](Cac)が上昇すると、輸送系1による、Ca2+のマトリックスへの流入が増加するが、輸送系2による、Ca2+の膜間スペースを経た、細胞質ゾルへの流出速度は、変化しない(流入>流出)。その結果、ミトコンドリア内(マトリックス)の[Ca2+](Cam)は、増加し、細胞質ゾルの[Ca2+]は、もとのレベルに低下する。逆に、細胞質ゾルの[Ca2+](Cac)が低下すると、輸送系1による、Ca2+のマトリックスへの流入が低下するが、輸送系2による、Ca2+の膜間スペースを経た、細胞質ゾルへの流出速度は、変化しない(流入<流出)。その結果、実質的に、Ca2+は、マトリックスから、細胞質ゾルに流出して、細胞質ゾルの[Ca2+](Cac)は、もとのレベルに増加する。
このようにして、細胞質ゾルの[Ca2+](Cac)は、一定に維持される:ミトコンドリア外(細胞質ゾル)の自由な[Ca2+](extramitochondrial free [Ca2+]=Cao )は、0.5-1.0μM(0.1-1μM)に維持される。なお、細胞内(細胞質ゾル)Ca2+濃度(Cac)は10-7Mで、細胞外Ca2+濃度(Cao)の10-3M、小胞体内Ca2+濃度の10-3M(1mM=1mEq/L)よりも、10,000倍も低い(注5)。
細胞質ゾルの[Ca2+](Cac:細胞内カルシウムイオン濃度)は、静止期は、0.06~0.2μM(10-8~10-7M)に維持されている。
細胞質ゾルの[Ca2+](Cac)は、刺激期には、細胞外Ca2+(細胞外カルシウム)が、細胞膜の電位依存性Ca2+チャネル(VDCC)や、受容体構成Ca2+チャネル(NMDAグルタミン酸受容体)などを経て、細胞外から細胞質ゾルに流入し、また、ミトコンドリア内Ca2+が、輸送系2(NCE)などにより、細胞質ゾルに放出され、1~10μM(10-6~10-5M)に、上昇する。細胞内の微小管は、Ca2+濃度(Cac)が、10-5Mより高くなると短縮し、短縮状態が長時間続くと、微小管は崩壊してしまう。このように、細胞質ゾルの[Ca2+](Cac)が、高濃度に上昇した状態が持続することは、細胞にとって好ましくないと言われる。
細胞質ゾルの[Ca2+](Cac)が上昇すると、Ca2+排出機構である、Ca2+-ATPase(細胞膜、小胞体膜に存在)や、細胞膜のNa+-Ca2+交換輸送体(NCE)により、細胞外に輸送され、また、輸送系1(Ca2+-uniporter)によりミトコンドリア内に輸送され、静止期のレベルに、低下する。
Ca2+-ATPase(Caポンプ)や、細胞膜のNa+-Ca2+交換輸送体(NCE)は、細胞質ゾルの[Ca2+](Cac)を汲み出し、細胞質ゾルの[Ca2+](Cac)を一定の濃度に維持する。Ca2+は、筋小胞体に、Ca2+-ATPase(Caポンプ)により汲み出される(取り込まれる)と、蓄積し、筋収縮時には、多量に放出されるので、筋収縮力などが亢進する。
表1 哺乳類細胞のイオン濃度
| イオン |
細胞内(mM) |
細胞外(mM) |
| Na+ |
10 |
140 |
| K+ |
140 |
5 |
| Ca2+ |
0.0001(10-7M) |
1-2 |
| Mg2+ |
58 |
1-2 |
| Cl- |
5 |
110 |
| HCO3- |
10 |
28 |
| リン酸 |
75 |
4 |
Zhu等の培養細胞を用いた実験結果によると、ミトコンドリア内Ca2+濃度([Ca2+]:Cam)が減少すると、膜電位(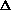
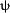 m:
m: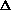
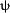 )は低下し、その後、シトクロムc(cytochrome c)の放出など、アポトーシス(apoptosis)が起こり、細胞は死ぬ。反対に、トコンドリア内Ca2+濃度([Ca2+]:Cam)が増加ししても、膜電位(
)は低下し、その後、シトクロムc(cytochrome c)の放出など、アポトーシス(apoptosis)が起こり、細胞は死ぬ。反対に、トコンドリア内Ca2+濃度([Ca2+]:Cam)が増加ししても、膜電位(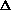
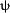 m)は低下するが、細胞は、アポトーシスでなく、壊死(necrosis)で、死ぬ(注6)。
m)は低下するが、細胞は、アポトーシスでなく、壊死(necrosis)で、死ぬ(注6)。
Al-Nasserの実験結果では、PTPが開口すると、ミトコンドリアが膨化し、膜電位が低下し、ミトコンドリア内に蓄積されていたCa2+(accumulated Ca2+)が、放出される。
Bernardiの実験結果では、PTP(の開口)は、Ca2+の存在下でも、非存在下でも、膜電位(the proton electrochemical gradient:delta mu H+)で制御されていて(controlled)、膜電位の崩壊(a collapse of the membrane
potential)が原因(cause)で、PTPが開口する。
ミトコンドリア内(マトリックス)が酸性だと(at acidic matrix pH values)、PTPの開口(induction)は、防止された。ミトコンドリア内にCa2+が蓄積すると、マトリックスがアルカリ性になり、膜電位の低下(menbrane depolarization)が起こる。
PTPの開口(induction)は、Ca2+に依存する:Ca2+が、ミトコンドリア内に流入すると、膜透過性が亢進し、ミトコンドリアの膨化、膜電位の低下が起こる。Ca2+(Camの増加)が、ミトコンドリア内で、膜電位(delta mu H+:⊿μH+)を変化させ、PTPの開口(induction)を引き起こすためとも考えられている。
なお、PTPの開口がCa2+に依存するのは、PTP(a non-specific pore)を構成する為には、ANT(adenine nucleotide translocase) が、CyP-D(cyclophilin-D)と結合する際に、Ca2+を介する変化( a calcium-mediated conformational change.)が必要な為とする説もある(Halestrap)。酸化ストレス(oxidative stress)は、CyP-DのANTへの結合を、増加させる。細胞内pHが、7.0以下に低下すると、Ca2+によるPTPの開口(ミトコンドリア内膜の透過性亢進:mitochondrial permeability
transition)は、起こりにくくなる。
若年性皮膚筋炎(juvenile dermatomyositis:JDM)では、筋線維内鞘の毛細血管内皮細胞に、自己抗体が結合し、補体C3が活性化され、血管炎が起こる。
若年性皮膚筋炎では、軟部組織の石灰化が、特徴的症状だが、石灰化の中心は、カルシウムアパタイト(カルシウムリン灰石)。カルシウムは、障害された筋のミトコンドリアから、放出される。活性化されたマクロファージが、(IL-1β、IL-6、TNF-αを産生し、)石灰化を来たす。
4.H+やK+の輸送系
1).H+/K+交換輸送体(H+/K+ exchanger:KHE)
H+-K+交換輸送体(H+-K+ exchanger)は、 H+-K+ antiporterとも呼ばれる。
H+-K+ exchanger(H+-K+交換輸送体)は、K+をマトリックスからミトコンドリア外に流出(efflux)させ、交換に、H+をミトコンドリア内(マトリックス)に流入(influx)させる(antiporterは、逆の方向にも、物質を輸送する)。
H+-K+ exchanger(KHE)は、特異性が低い:H+-K+ exchanger が、H+と交換に輸送するのは、K+に限らない。H+-K+ exchanger は、K+と、Na+と、Li+とを、区別しない(does not discriminate)ので、H+と交換に、Na+や、Li+をも、ミトコンドリア内に流入させる(輸送する)。
従って、H+-K+ exchangerは、非特異的に、H+-Na+ exchanger(NHE、H+-Na+ antiporter)としても機能する。
H+-K+ exchangerの活性は、マトリックスの遊離(free)Mg2+濃度が低下すると、増加する。H+-K+ exchangerの活性は、低浸透圧液(hypotonic media)内や、浸透圧膨張(osmotic swelling)後に、増加する。
H+-K+ exchangerの活性は、ミトコンドリア内の遊離Mg2+(free matrix Mg2+)が低下すると、上昇する。
また、H+-K+ exchangerの活性は、ミトコンドリア内のpHを上昇させると、増加する。H+-K+ exchangerの活性は、マトリックスのH+により、抑制される(Beavis等)。
2).Na+/H+交換輸送体(Na+/H+ exchanger:NHE)
総ての組織のミトコンドリアには、Na+/H+交換輸送体(Na+/H+ exchanger:NHE)も存在する。
NHE(Na+/H+ exchanger)は、ミトコンドリア内のpHや、容量(浸透圧)を調節する:ミトコンドリア内のNa+をミトコンドリア外に、ミトコンドリア外のH+を、ミトコンドリア内(マトリックス)に輸送する。
NHE(Na+/H+交換輸送体)は、H+を輸送するが、K+の輸送は行わない。
NHEの最適pHは、7.0であり、NHEの活性は、pHが上昇すると、直線的に、低下する。
NHE(Na+/H+ antiporter)は、NCE(Na+/Ca2+ antiporter)より、作用が、早い。
NHEは、恐らく、輸送系1(Ca2+-uniporter)と、輸送系2(Na+/Ca2+ antiporter)の共役によって営まれる、Ca2+濃度の維持(steady-state
Ca2+ cycling)に、貢献している。
5.クエン酸の輸送系
ミトコンドリア内(マトリックス)のクエン酸は、担体蛋白質(CIC)により、ミトコンドリア外に輸送され、交換に、ミトコンドリア外のリン酸が、ミトコンドリア内に、輸送される。
ミトコンドリア内で、ATPやNADH2+が十分に生成され、TCA回路で、イソクエン酸デヒドロゲナーゼが抑制され、クエン酸が、ミトコンドリア内にかなり蓄積すると、クエン酸は、tricarboxylate
antiporterにより、細胞質に輸送される。その際、tricarboxylate antiporterにより、H+も細胞質に輸送され、交換に、リンゴ酸がミトコンドリア内に輸送される。ミトコンドリア内で、クエン酸合成により、オキサロ酢酸が消費されるので、クエン酸が、ミトコンドリア外へ輸送されるのと交換に、リンゴ酸(オキサロ酢酸に変換され得る)が、ミトコンドリア内に輸送されるのは、都合が良い。また、交換にミトコンドリア内輸送されたリンゴ酸は、必要な場合は、dicarboxylate
antiporter(dicarboxylic acid antiporter)により、ミトコンドリア外に輸送され、交換に、ミトコンドリア外のリン酸(HPO42-)が、ミトコンドリア内に輸送される。リンゴ酸は、リンゴ酸-α-ケトグルタル酸輸送体(α-ketoglutarate antiporter)により、ミトコンドリア外に輸送され、交換に、ミトコンドリア外のα-ケトグルタル酸が、ミトコンドリア内に輸送される。
クエン酸は、細胞質で、ACC(acetyl-CoA carboxylase)を活性化させ、脂肪酸合成を促進させ、PFK-1を阻害して、解糖を抑制する。
肝臓や脂肪細胞では、クエン酸のミトコンドリア外への輸送に伴ない、細胞質ゾルでの脂肪酸合成が、始まる。クエン酸は、細胞質のATP-クエン酸リアーゼにより、アセチル-CoAと、オキサロ酢酸とに、分解される。アセチル-CoAは、脂肪酸合成に使われ、オキサロ酢酸は、リンゴ酸に戻され(還元され)、ミトコンドリア内に、輸送される(オキサロ酢酸は、糖新生にも、使われる)。また、リンゴ酸は、リンゴ酸酵素(malic enzyme)により、ピルビン酸に変換され(ピルビン酸は、ミトコンドリア内に輸送され、オキサロ酢酸に変換される)、この際、脂肪酸合成に必要な、NADPHが生成される。
リンゴ酸 + NADP+ ⇔ ピルビン酸 + 二酸化炭素 + NADPH
細胞質には、アコニターゼ(aconitase)や、イソクエン酸デヒドロゲナーゼが存在するので、クエン酸は、イソクエン酸を経て、α-ケトグルタル酸に変換され、その際、NADPH(脂肪酸合成に必要)が、生成される。α-ケトグルタル酸は、リンゴ酸-α-ケトグルタル酸輸送体(α-ketoglutarate antiporter)により、ミトコンドリア内に輸送され、交換に、ミトコンドリア内のリンゴ酸が、ミトコンドリア外に輸送される。
このように、ミトコンドリア外のリンゴ酸は、ミトコンドリア内のクエン酸が、ミトコンドリア外に輸送される際に、交換に、ミトコンドリア内に輸送され、また、ミトコンドリア外に輸送されたクエン酸の代謝産物であるα-ケトグルタル酸が、ミトコンドリア内に輸送される際に、交換に、ミトコンドリア外に輸送される。
6.その他
・ミトコンドリア外膜には、ポリン(porin)と言う穴構造(外膜チャネル)が存在し、大きさ10kD以下の分子は、自由拡散で通過する。従って、膜間スペース(膜間腔)の代謝産物やイオンの濃度は、ミトコンドリア外(細胞質ゾル)と同等になっている。
・オキサロ酢酸,、乳酸は、ミトコンドリア内膜や外膜を通過して、ミトコンドリア内(マトリックス)と、ミトコンドリア外(細胞質ゾル)間を移動出来ない。
・ピルビン酸は、ピルビン酸-H+共輸送体(ピルビン酸-H+共輸送系)により、水素イオン(H+:プロトン)と共に、ミトコンドリア内膜や外膜を通過して、マトリックスと、細胞質ゾル間を移動出来る。
・リンゴ酸、α-ケトグルタル酸は、リンゴ酸-α-ケトグルタル酸輸送体により、グルタミン酸、アスパラギン酸は、グルタミン酸-アスパラギン酸輸送体により、それぞれ、ミトコンドリア内膜や外膜を通過して、マトリックスと、細胞質ゾル間を移動出来る。
・脂肪酸は、acyl-CoAとなった後、カルニチンと結合して、ミトコンドリア内膜を通過して、マトリックスに移動し、β-酸化される。
・グリセロール(グリセリン)、エタノール(エチルアルコール)、酢酸は、両新媒性の低分子化合物であり、生体膜(細胞膜)を自由に通過出来る。
・リン酸(Pi)は、膜間スペース(膜間腔)からミトコンドリア内に輸送され、交換に、水酸化イオン(OH-)が、ミトコンドリア内から、膜間スペースに輸送される。
注1:ミトコンドリア外で行われる解糖で、1分子のブドウ糖(グルコース)が、2分子のピルビン酸に分解される際に、差し引き、2分子のNADH2+と、2分子のATPとが、生成される。
2分子のピルビン酸は、ミトコンドリア内に輸送されて、TCA回路で代謝され、6分子のNADH2+と、2分子のFADH2と、2分子のGTPとが、生成される。
ミトコンドリア内では、この他、脂肪酸のβ-酸化により生成されるアセチル-CoAが、TCA回路で代謝され、NADH2+が生成される。
注2:リンゴ酸-アスパラギン酸シャトルを構成する、リンゴ酸輸送系(リンゴ酸-α-ケトグルタル酸輸送体)による輸送は、可逆的で、リンゴ酸(NADH2+)を、ミトコンドリア内から、ミトコンドリア外に輸送したり(糖新生時)、反対に(逆に)、リンゴ酸(NADH2+)を、ミトコンドリア外から、ミトコンドリア内に輸送する(運動時)。
しかし、リンゴ酸-アスパラギン酸シャトルでは、ミトコンドリア内のm-AST(m-GOT)による反応は、オキザロ酢酸を、アスパラギン酸に変換する方向に進行し、逆行しないと言う。従って、リンゴ酸-アスパラギン酸シャトルを構成する、グルタミン酸-アスパラギン酸輸送体による輸送は、もっぱら、ミトコンドリア内のアスパラギン酸を、ミトコンドリア外に輸送し、ミトコンドリア外のグルタミン酸を、ミトコンドリア内に輸送する。
注3:ミトコンドリア内へCa2+(カルシウムイオン)を輸送する(流入させる、取り込む)輸送系1では、ミトコンドリア内(マトリックス)が、負(-)に分極していることに依存している。輸送系1を担う分子は、mCU(mitochondrial Ca2+ uniporter)と命名されている。mCUによるCa2+取り込み輸送は、Chlorpromazine、Imipramineなどの向精神薬(精神安定剤)により、阻害される。mCUによる、ミトコンドリア内へのCa2+取り込みは、ミトコンドリア内(マトリックス)が、負(-)に分極している膜電位(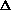
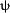 m)に依存している。従って、脱共役剤(CCCP、FCCPなど)により、膜電位が消失すると、ミトコンドリア内へのCa2+取り込みが、行われない。
m)に依存している。従って、脱共役剤(CCCP、FCCPなど)により、膜電位が消失すると、ミトコンドリア内へのCa2+取り込みが、行われない。
ミトコンドリア外へCa2+を輸送する(流出させる)輸送系2を担う分子は、mNCE(mitochondrial Na+-Ca2+ exchanger)と命名されている。mNCEによるCa2+流出輸送は、Clonazepamなどの向精神薬(精神安定剤)により、阻害される。
mPTP(mitochondrial permeability transition pore)分子は、VDAC(voltage-dependent
anion channel:電位依存性陽イオンチャネル、porinと同じ)、ANT(adenine nucleptide translocase:ATP-ADP輸送体である、ATP-ADPトランスロケータ)、CyP-D(cyclophilin-D)の複合体と考えられている。mPTPは、生理的条件下では開口しないが、アポトーシス誘発因子のBaxは、mPTPを開口させる。mPTPが開口すると、ミトコンドリア内(マトリックス)に、細胞質ゾルから流入が起こり、ミトコンドリアは膨化し、アポトーシスが惹起される。
小胞体内は、Ca2+濃度が高いが、ミトコンドリアは、小胞体と、密な接触があると言う。
IP3(イノシトール3リン酸)は、小胞体のCa2+チャネル(IP3受容体)に結合して、Ca2+を細胞質ゾルに放出させたり、ミトコンドリアから、Ca2+を細胞質ゾルに放出させ、細胞内Ca2+濃度を上昇させる。細胞膜のCaチャネルからも、Ca2+が細胞内に流入する。
シクロフィリンには、多数のファミリー蛋白質が存在するが、シクロフィリンD(CyP-D)は、ミトコンドリアに局在する。
シクロフィリンD(CyP-D:cyclophilin-D)は、ミトコンドリア膜透過性遷移現象(mitochondrial membrane permeability transition:MPT)に関与する。MPTは、カルシウム依存性(Ca2+依存性)に、内膜の透過性が亢進し、その結果、ミトコンドリアの膜電位の低下、膨化、ミトコンドリア外膜の崩壊を伴うミトコンドリアの脱機能が、起こる。
シクロフィリンD(CyP-D)は、通常、ミトコンドリアのマトリックスに存在し、MPTに際して、ミトコンドリア内膜に移行する。そして、シクロフィリンDは、内膜に存在するANT、外膜に存在するVDACなどと、MPTポア複合体(mPTP分子)を形成する。なお、ANTは、MPTに必須でないと言う。
MPTポア複合体(mPTP分子)は、アポトーシス時のミトコンドリア外膜透過性亢進現象に関与すると考えられて来たが、シクロフィリンDを欠損したマウスの実験結果から、シクロフィリンD依存的なMPTポア複合体(シクロフィリンDを含むmPTP分子)は、アポトーシスに関与しないと言う。また、MPTポア複合体(mPTP分子)は、活性酸素や、過剰な細胞内カルシウムにより誘導されるネクローシス(壊死)に関与する(重要な役割を果たす)。
シクロフィリンDを欠損したマウスは、心臓や脳を、虚血・再灌流しても、障害が起こりにくい(虚血によるネクローシスが、起こりにくい)。心筋梗塞や脳梗塞では、、シクロフィリンD依存的なMPTポア複合体(シクロフィリンDを含むmPTP分子)によるネクローシスが関与していると、考えられている。
注4:Ca2+(カルシウムイオン)は、ミトコンドリアでのエネルギー産生(ATP産生)を調節する。
Ca2+は、エネルギー産生(ATP産生)に関与する、ミトコンドリア内の3つの酵素活性を調節する。3つの酵素とは、ピルビン酸脱水素酵素(pyruvate dehydrogenase complex)、イソクエン酸脱水素酵素(NAD+-linked isocitrate dehydrogenase)、α-ケトグルタル酸脱水素酵素(2-oxoglutarate
dehydrogenase)。
細胞質ゾルのCa2+([Ca2+]c:Cac)濃度が上昇し、ミトコンドリアが、Ca2+を取り込む(uptake)と、これらの酵素活性が、高まり、エネルギー産生(ATP産生)が、増加する。従って、ミトコンドリア内へのCa2+輸送は、生体のエネルギー需要が高まって、エネルギー産生を必要としていることを伝える(relay)ことが、重要な作用の一つ。
ミトコンドリア内へのCa2+輸送(ミトコンドリアのCa2+取り込み)により、酵素活性が活性化され、エネルギー産生(ATP産生)が高まる。
細胞質ゾルの[Ca2+](Cac)が上昇すると、ミトコンドリア内へのCa2+輸送により、酵素活性が活性化され、エネルギー産生(ATP産生)が高まる。
なお、ミトコンドリア内Ca2+濃度( [Ca2+]m:Cam)は、心筋細胞では、非収縮時(a resting level)は<100nMで、頻回の収縮時(over the course of many contractions)には、600nMに増加する。
注5:細胞内カルシウム濃度(Ca2+濃度)は、細胞外カルシウム濃度より、10,000倍も低い。その為、細胞成分を主体とする肉類(豚肉、鶏肉など)は、細胞外ミネラルであるカルシウム含有量が、少ない。
なお、魚類は、カルシウム含量が多い。大豆製品(豆腐、納豆)は、カルシウム含量が多い。御飯(精白米)より、パン(小麦粉)の方が、カルシウム含量が多い。葉物野菜(ほうれんそうなどの葉菜類)は、カルシウム含量が多いが、果実野菜(トマトなど)は、カルシウム含量が少ない。
表2 食品のカルシウム含有量
| 食品 |
カルシウム(Ca) |
リン(P) |
| ぶた(ロース、脂身つき) |
4 |
130 |
| 若鶏 |
5 |
180 |
| 焼きさんま |
90 |
200 |
| はまぐり(水煮) |
120 |
140 |
| 豆腐(木綿) |
120 |
85 |
| 糸引納豆 |
90 |
190 |
| めし(精白米) |
4 |
130 |
| 食パン(市販) |
36 |
70 |
| ほうれんそう(ゆで) |
60 |
60 |
| トマト(果実) |
9 |
18 |
注6:Zhu等によると、ミトコンドリア内Ca2+濃度(Cam)が減少すると、アポトーシスが起こると言う。
培養細胞を用いた実験結果によると、細胞外(培養液)のCa2+濃度(Cao)を低くすると、早期に、ミトコンドリア内Ca2+濃度(Cam)と、膜電位(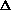
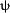 :
: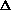
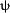 m)とが、減少(reduction)し、その後、シトクロムc(cytochrome c)が放出され、カスパーゼ(caspase)が活性化され、アポトーシス(apoptosis)が起こる。ミトコンドリアのPTP(mitochondrial permeability transition pore)を阻害する、シクロスポリンA(cyclosporin
A)や、Bcl-2は、ミトコンドリア内Ca2+(Cam)の放出を阻害し、アポトーシスを抑制した。
m)とが、減少(reduction)し、その後、シトクロムc(cytochrome c)が放出され、カスパーゼ(caspase)が活性化され、アポトーシス(apoptosis)が起こる。ミトコンドリアのPTP(mitochondrial permeability transition pore)を阻害する、シクロスポリンA(cyclosporin
A)や、Bcl-2は、ミトコンドリア内Ca2+(Cam)の放出を阻害し、アポトーシスを抑制した。
反対に、(培養液のCa2+濃度を高め、)ミトコンドリアにCa2+を過補充(overload)し、ミトコンドリア内Ca2+濃度([Ca2+]:Cam)を高めると、細胞は、アポトーシスでなく、壊死(necrosis)で、死ぬ:細胞外Ca2+(Cao)が過剰に存在すると、ミトコンドリア内Ca2+(Cam)も増加し、同時に、1時間後をピークに、膜電位(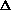
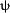 m)が低下(decrease)し、2時間後には、壊死(necrosis)が起こる。
m)が低下(decrease)し、2時間後には、壊死(necrosis)が起こる。
ミトコンドリア内Ca2+濃度(Cam)の低下と、膜電位(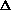
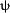 m)の低下は、アポトーシスの共役した反応(a coupled reaction for apoptosis)だが、両者は、壊死では、脱共役(was
uncoupled)している:壊死では、ミトコンドリア内Ca2+濃度(Cam)が上昇すると、膜電位(
m)の低下は、アポトーシスの共役した反応(a coupled reaction for apoptosis)だが、両者は、壊死では、脱共役(was
uncoupled)している:壊死では、ミトコンドリア内Ca2+濃度(Cam)が上昇すると、膜電位(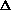
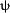 )m)が低下し、壊死が起こる。
)m)が低下し、壊死が起こる。
クロナゼパム(Clonazepam)は、ミトコンドリアのNa+-Ca2+交換輸送体(Na/Ca exchanger)を比較的特異的に阻害する。クロナゼパムは、(培養液の高いCa2+濃度の為に、)過剰に増加したミトコンドリア内Ca2+濃度(Cam)を軽減させ、壊死から、細胞を防御することが出来ると言う(この論文で、ミトコンドリアの「Na/Ca exchanger」とは、輸送系2のことのようだが、輸送系2だと、Ca2+を、ミトコンドリア内からミトコンドリア外に輸送するので、阻害すると、ミトコンドリア内Ca2+濃度のCamは、むしろ増加すると考えられる)。
なお、小胞体(endoplasmic reticulum)では、Ca2+-ATPaseが、Ca2+を、小胞体内に蓄積させる。thapsigarginは、小胞体(endoplasmic reticulum)のCa2+-ATPaseを強力に阻害する。thapsigarginは、多くの培養細胞株(various cell lines.)に、アポトーシスを誘導する。胸腺細胞(thymocytes)は、極く少量のthapsigarginによりアポトーシスが誘導されるが、PTP(の開口)を阻害するシクロスポリンA(cyclosporin
A)は、このアポトーシスを、阻害出来る。しかし、thapsigarginは、細胞外(extracellular)のCa2+(Cao)を除去し(after removal)、ミトコンドリア内Ca2+(Cam)が蓄積しないようにしても、アポトーシスを誘導する。
参考文献
・ハーパー・生化学(原著14版、三浦義彰監訳、丸善株式会社、 1975年).
・ヴォート基礎生化学(東京化学同人、第1版第4刷、2003年).
・鈴木紘一、他:ホートン生化学 第3版(東京化学同人、2005年、第3刷).
・小林信一:総説 若年性皮膚筋炎 日本小児科学会雑誌 109巻6号、714-725、2005年.
・今井正、他:標準薬理学 第6版 (医学書院、2001年).
・田川邦夫:からだの働きからみる代謝の栄養学 タカラバイオ株式会社(2003年).
・辻本賀英:ことばのカルテ78 シクロフィリンD Medical Tribune Vol.38,
No.45, 35頁(2005年11月10日).
・一木貴、他:新生時期発症のpyruvate carboxylase欠損症-臨床的に診断でき、早期より治療法を検討した症例- 日本小児科学会雑誌 90巻10号、2164-2170、1986年.
・Szewczyk A, et al (2002) Mitochondria as a Pharmacological Target.
Pharmacological Reviews 54:101-128.
・Zhu LP, et al (2000) Mitochondrial Ca2+
homeostasis in the regulation of apoptotic and necrotic cell death. Cell
Calcium 28: 107-117.
・Bernardi P (1999) Mitochondrial Transport of Cations: Channels, Exchangers,
and Permeability Transition. Physiological Reviews 79:1127-1155.
・Halestrap AP (1999) The mitochondrial permeability transition: its molecular mechanism and role in reperfusion injury. Biochem Soc Symp 66: 181-203.
・Al-Nasser IA (1999) Salicylate-induced kidney mitochondrial permeability transition is prevented by cyclosporin A. Toxicol Lett 105: 1-8.
・Bernardi P (1992) Modulation of the mitochondrial cyclosporin A-sensitive permeability
transition pore by the proton electrochemical gradient. Evidence that the
pore can be opened by membrane depolarization. J Biol Chem 267: 8834-8839.
・Beavis AD, et al (1990) Evidence for the allosteric regulation of the mitochondrial
K+/H+
antiporter by matrix protons. J. Biol. Chem. 265: 2538-2545, 1990.
・Vincenzo Zara, et al (2005) Import of rat mitochondrial citrate carrier
(CIC) at increasing salt concentrations promotes presequence binding to
import receptor Tom20 and inhibits membrane translocation. Journal of Cell Science 118, 3985-3995.
|トップページ|脂質と血栓の関係|ミニ医学知識|生化学の知識|医学の話題|小児科疾患|生命の不思議|リンク集|



)に依存している。
)が、マトリックス側が負(-)な為、陽イオンのCa2+を引き寄せ、Ca2+が流入する。輸送体1によるCa2+の流入(influx)は、呼吸鎖により、H+がミトコンドリア外に流出(efflux)することに、依存する。
m:
)は低下し、その後、シトクロムc(cytochrome c)の放出など、アポトーシス(apoptosis)が起こり、細胞は死ぬ。反対に、トコンドリア内Ca2+濃度([Ca2+]:Cam)が増加ししても、膜電位(
m)は低下するが、細胞は、アポトーシスでなく、壊死(necrosis)で、死ぬ(注6)。
m)に依存している。従って、脱共役剤(CCCP、FCCPなど)により、膜電位が消失すると、ミトコンドリア内へのCa2+取り込みが、行われない。
:
m)とが、減少(reduction)し、その後、シトクロムc(cytochrome c)が放出され、カスパーゼ(caspase)が活性化され、アポトーシス(apoptosis)が起こる。ミトコンドリアのPTP(mitochondrial permeability transition pore)を阻害する、シクロスポリンA(cyclosporin A)や、Bcl-2は、ミトコンドリア内Ca2+(Cam)の放出を阻害し、アポトーシスを抑制した。
m)が低下(decrease)し、2時間後には、壊死(necrosis)が起こる。
m)の低下は、アポトーシスの共役した反応(a coupled reaction for apoptosis)だが、両者は、壊死では、脱共役(was uncoupled)している:壊死では、ミトコンドリア内Ca2+濃度(Cam)が上昇すると、膜電位(
)m)が低下し、壊死が起こる。